원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (1)
Valence Shell Electron Pair Repulsion, VSEPR
---------------------------------------------------
▶ 참고: 전자 영역 (Electron Domains)
[ https://ywpop.tistory.com/2569 ]
---------------------------------------------------
중심 원자의 전자 영역 개수만 알면,
( 전자 영역 = 입체수, steric number )
대략적인 분자의 기하 구조는 바로 예측할 수 있으며,
그 구조는 아래 표와 같다.
[표] 전자 영역별 기하 구조

> 직선형 linear, 삼각평면 trigonal planar, 사면체 tetrahedral
> 삼각이중피라미드 trigonal bipyramidal, 팔면체 octahedral
---> VSEPR에 따라, 전자쌍 간 반발력이 최소인 기하 구조.
( 이 표는 반드시 암기할 것. 이 표만 외우면 된다. )
※사면체 = 정사면체
( 참고 https://ywpop.blogspot.com/2024/06/blog-post_13.html )
※팔면체 = 정팔면체
※삼각피라미드 = 삼각뿔 (trigonal pyramid)
※삼각이중피라미드 = 삼각쌍뿔
※사각뿔 = square pyramid (square pyramidal)
[참고] 중심 원자의 전자 영역을 셀 줄 알면,
중심 원자의 혼성 오비탈도 알아낼 수 있다.
( 참고: 전자영역별 혼성오비탈 https://ywpop.tistory.com/11542 )
[주목]
중심 원자의 전자 영역(= 입체수)만 고려한
“전자 영역의 기하 구조”와
고립 전자쌍(비결합 전자쌍)까지 고려한
“분자의 기하구조”를 구분(구별)할 줄 알아야 한다.
[ 관련 글 https://ywpop.blogspot.com/2024/05/electron-domain-geometry-and-molecular.html ]
electron-domain geometry and molecular geometry
실제 분자의 기하 구조는
전자 영역을 차지하는 전자쌍들의 종류가 서로 다를 수 있기 때문에
( 단일결합, 이중결합, 삼중결합, 비공유전자쌍 )
위 기본 기하 구조가 약간 변형될 수도 있다.
그렇지만 기하 구조가 변형되더라도
① 위 기하 구조에서 출발하여 변형되기 때문에,
② 서로 다른 전자쌍들 사이의 반발력 크기만 알면,
실제 분자의 기하 구조 역시 어렵지 않게 예측할 수 있다.
[서로 다른 전자쌍들 사이의 반발력 크기]
① 비결합전자쌍(lone pair) 간 반발력 >
② 비결합전자쌍과 결합전자쌍 사이의 반발력 >
③ 결합전자쌍 간 반발력 (삼중결합전자 > 이중결합전자 > 단일결합전자)
전자쌍 반발력 크기순서는 각 전자쌍의 물리적 부피(덩치) 크기순과 일치한다.
두 원자 사이에 속박되어있는 결합전자는
한 원자에 속박되어있는(그만큼 자유로이 운동하는) 비결합전자보다
전자가 차지하는 부피가 작을 수밖에 없다.
그리고 단일결합보다는 다중결합에 전자가 많다보니,
다중결합의 전자 부피가 더 크다.
부피가 큰 전자쌍이 공간에서 넓은 자리를 차지하면,
부피가 작은 전자쌍은 상대적으로 좁은 자리를 차지할 것이다.
이 때문에 전자 영역 개수가 같은 분자들이라 하더라도
전자 영역을 차지하는 전자쌍의 종류가 다르면,
전자쌍 사이의 반발력 크기 차이로 인해 결합각이 달라져,
결국에는 전체 분자의 기하 구조가 약간 변형된다.
[참고] 강호동도 사람 1명, 유재석도 사람 1명이지만,
소형 경차의 좁은 뒷좌석에 앉았을 때
각자가 차지하는 자리의 크기는 다르다.
중심 원자의 전자 영역 개수가 3개인 분자를 예로 들어 설명하면,
① 3개 전자쌍의 종류가 모두 같다면 (예로, 모두 결합전자쌍이면)
> 3개 전자쌍 간 반발력 모두 동일
> 중심 원자를 중심으로 각 전자쌍은 평면에서 정확히 120도씩 떨어져 자리 차지
② 3개 중 한 개가 비결합전자쌍(또는 다중결합)이면
> 부피가 큰 비결합전자쌍은 넓은 자리 차지, 결합전자쌍들은 상대적으로 좁은 자리 차지
> 중심 원자를 중심으로 비결합전자쌍과 결합전자쌍 사이의 각도는 120도보다 증가하고, 결합전자쌍 사이의 각도는 120도보다 감소한다.
( 비결합전자쌍과 결합전자쌍 사이의 반발력 > 결합전자쌍 간 반발력 )

⇨ 예에서처럼, 삼각평면 구조를 유지하면서 결합각이 약간 달라질 뿐이다.
⇨ 실제 분자의 기하 구조를 예측할 수 있다.
원자의 크기는 전자가 돌아다니는 공간까지 포함한 크기이다.
원자번호가 증가할수록 전자의 수도 증가하므로,
전자가 차지하는 물리적 공간 역시 증가한다.
이 때문에 원자의 크기 또한 결합각에 영향을 준다.
[ 관련 글 https://ywpop.tistory.com/10581 ] 에테인의 결합각. 에텐의 결합각
▶ 전자영역별 결합각
> 전자영역 = 2 이면, 결합각은 ~180°
> 전자영역 = 3 이면, 결합각은 ~120°
> 전자영역 = 4 이면, 결합각은 ~109.5°
[도표] 입체수(steric number)와 비결합전자쌍 수에 따른 분자의 기하구조
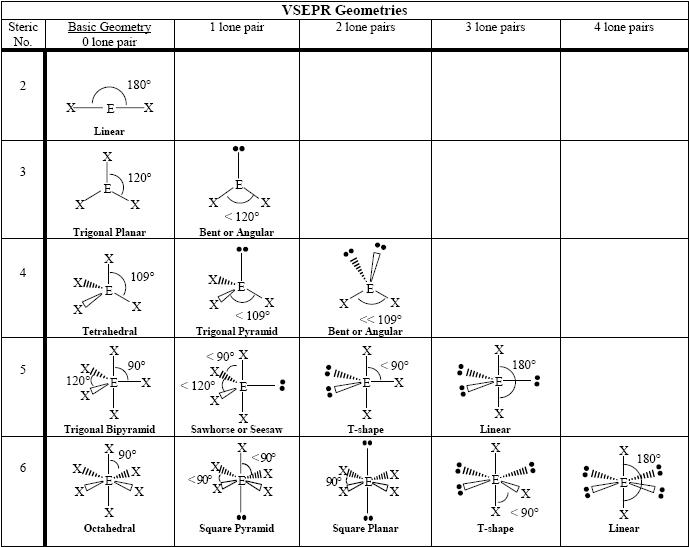
[ 그림 출처 https://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG ]
2: 선형(직선형)
3: 삼각 평면(평면 삼각형). 굽은형
4. 사면체형. 삼각뿔형. 굽은형
5. 삼각 쌍뿔형. 시소형(뒤틀린 사면체). T-형(T자형). 선형
6. 팔면체형. 사각뿔형. 사각 평면(평면 사각형). T-형. 선형
2: ① 선형(직선형)
3: ② 삼각 평면(평면 삼각형). ③ 굽은형
4. ④ 사면체형. ⑤ 삼각뿔형
5. ⑥ 삼각 쌍뿔형. ⑦ 시소형(뒤틀린 사면체). ⑧ T-형(T자형)
6. ⑨ 팔면체형. ⑩ 사각뿔형. ⑪ 사각 평면(평면 사각형)
( Linear, Trigonal planar, V-shaped bent, Tetrahedral, Trigonal pyramidal, Trigonal bipyramidal, Seesaw, T-shaped, Octahedral, Square pyramidal, Square planar )
[ 관련 글 https://ywpop.tistory.com/23782 ] ABx ABxEy별 분자 예시
[ 관련 글 http://xaktly.com/VSEPR.html ] VSEPR 이론
[ 관련 글 https://en.wikipedia.org/wiki/VSEPR_theory ] VSEPR theory
▶ NH3의 중심 원자, N의 전자 영역 = 4개
---> NH3의 VSEPR 기하 구조는 정사면체.

▶ N의 비공유전자쌍을 뺀, 즉 NH3 분자를 구성하는 원자만 고려하면,
---> Trigonal Pyramid = 삼각피라미드 = 삼각뿔
---> 실제 NH3 분자의 기하 구조
[ 참고 사이트 ] Molecular Structure and Polarity
[ 관련 글 https://ywpop.tistory.com/2573 ] VSEPR 모형으로 분자의 기하 구조 예측 (2)
[ 관련 글 https://ywpop.tistory.com/2574 ] VSEPR 모형으로 분자의 기하 구조 예측 (3)
[키워드] VSEPR 기준, VSEPR dic, 전자영역 사전, 전자영역 기준, 분자의 기하구조 기준, 분자의 입체구조 기준
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 혼성 오비탈 (hybrid orbital) ★ (9) | 2014.06.27 |
|---|---|
| 원자가 결합 이론. Valence Bond Theory, VBT (3) | 2014.06.27 |
| Sulfur Tetrafluoride(SF4) 분자의 Seesaw Molecular Geometry 설명 (0) | 2014.05.30 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (3) (0) | 2014.05.29 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (2) (0) | 2014.05.29 |
| 분자의 기하 구조와 원자가 껍질 전자쌍 반발 모형 (VSEPR model) (2) | 2014.05.27 |
| 형식 전하와 루이스(Lewis) 구조. CO2의 루이스 구조 (5) | 2014.05.27 |
| ClF3 루이스 구조 그리기 (0) | 2014.05.18 |

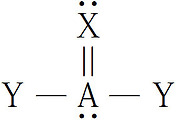

댓글