질소의 혼성 오비탈. hybridization of nitrogen
---------------------------------------------------
▶ 참고: 혼성 오비탈. hybrid orbital
[ https://ywpop.tistory.com/2639 ]
---------------------------------------------------
[1] sp^3 hybridization of nitrogen
① 4개의 sp^3 혼성오비탈
> 3개의 시그마 결합(σ-bond) 형성 + 1개의 고립 전자쌍(lone pair)
② 0개의 p 비혼성(원자) 오비탈
③ total 3개의 결합 = 3개의 시그마 결합
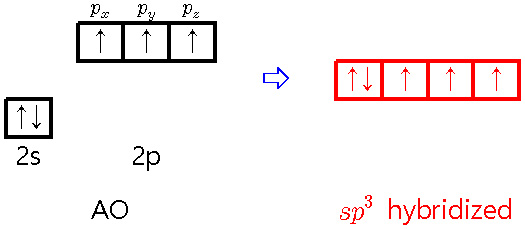
예) NH3의 N

[2a] sp^2 hybridization of nitrogen
① 3개의 sp^2 혼성오비탈
> 2개의 시그마 결합 형성 + 1개의 고립 전자쌍
② 1개의 p 비혼성(원자) 오비탈
> 1개의 파이 결합(π-bond) 형성
> p 비혼성 오비탈에 홀전자가 존재해야
파이 결합을 형성할 수 있다.
> p 비혼성 오비탈에 짝진 전자, 즉 전자쌍이 존재하면,
파이 결합을 형성할 수 없다.
> 홀전자가 존재하는 p 비혼성 오비탈의 개수 = 파이 결합의 개수
③ total 3개의 결합 = 2개의 시그마 결합 + 1개의 파이 결합

예) pyridine의 N

[2b] sp^2 hybridization of nitrogen
① 3개의 sp^2 혼성오비탈
> 3개의 시그마 결합 형성
② 1개의 p 비혼성(원자) 오비탈
> 1개의 고립 전자쌍
③ total 3개의 결합 = 3개의 시그마 결합
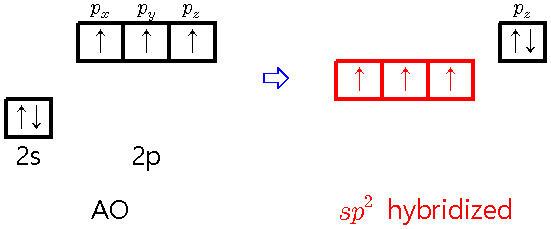
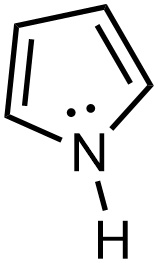
예) pyrrole의 N
The lone pair electrons on the sp2-hybridized nitrogen
are part of the aromatic sextet.
[ 자료 출처 ]
[3] sp hybridization of nitrogen
① 2개의 sp 혼성 오비탈
> 1개의 시그마 결합 형성 + 1개의 고립 전자쌍
② 2개의 p 비혼성(원자) 오비탈
> 2개의 파이 결합 형성
③ total 3개의 결합 = 1개의 시그마 결합 + 2개의 파이 결합
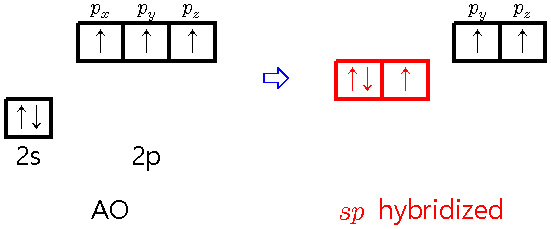
예) HCN의 N
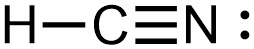
[참고] 분자의 종류에 상관없이,
즉 결합에 참여하는 원자의 종류에 상관없이,
> 단일 결합 (1개의 결합) = 시그마 결합 1개
> 이중 결합 (2개의 결합) = 시그마 결합 1개 + 파이 결합 1개
> 삼중 결합 (3개의 결합) = 시그마 결합 1개 + 파이 결합 2개
예를 들어, C≡C 이든, C≡N 이든, N≡N 이든,
삼중 결합이면, 시그마 결합 1개 + 파이 결합 2개.
[ 관련 글 https://ywpop.tistory.com/2938 ] 탄소의 혼성 오비탈
[키워드] 질소의 혼성 오비탈 기준문서, sp3 질소 사전, sp2 질소 사전, sp 질소 사전, 질소의 혼성 오비탈 사전
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 혼성 오비탈과 탄소-탄소 결합 에너지. s 오비탈의 비율 (0) | 2019.03.15 |
|---|---|
| 루이스 구조(Lewis structure) 그리기. NO (0) | 2019.01.14 |
| 에틸렌글리콜의 기하구조와 극성. 부동액 (2) | 2018.12.12 |
| 루이스 구조(Lewis structure) 그리기. BH3 (2) | 2018.11.17 |
| NH3의 쌍극자모멘트와 NF3의 쌍극자모멘트 (0) | 2018.10.16 |
| 단일결합과 다중결합. bond rotation (0) | 2018.10.12 |
| N2F2 분자는 극성인가 무극성인가 ★ (0) | 2018.10.10 |
| CS2는 극성 분자? 무극성 분자? (0) | 2018.10.08 |




댓글