NH4^+는 극성 분자인가? 쌍극자모멘트 값은?
ammonium NH4^+ polar or nonpolar molecule?
NH4^+는 분자가 아닌 이온입니다.
( NH4^+ is an ion, not a molecule. )
따라서 극성/무극성 자체를 따질 수 없습니다.
( The terms ‘polar’ and ‘non-polar’ don't apply to ions. )
왜냐하면, 이온은 이온결합 화합물의 일부이고,
이온결합 화합물은 정의상, 극성 물질로 간주하기 때문입니다.
( The reason is that ions must be part of an ionic compound,
and the ionic compound would be considered polar by definition. )
[참고] 이온결합 화합물을 극성 물질로 간주합니다만,
엄밀히 말하면, 극성/무극성 구분은 공유결합 화합물에만 해당됩니다.
---> 극성/무극성은 공유 결합에 대해 배울 때
처음으로 나온다는 것을 기억하세요.
( 참고 https://ywpop.tistory.com/2581 )
---> 왜 극성/무극성을 따지는지도 생각해 보세요.
예를 들어, NH4Cl은 이온결합 화합물이고, 따라서 극성 물질입니다.
여기서 NH4^+ 가 극성이냐고 묻는 것은, Cl^- 가 극성이냐고 묻는 것과 같습니다.
쌍극자모멘트의 경우, NH4^+의 구조가 정사면체 구조이기 때문에,

쌍극자모멘트 값은 ‘0’입니다.
따라서 분자라면 무극성 물질이 됩니다.
그러나 NH4^+는 이온이라서 극성 물질이며,
따라서 물과 같은 극성 용매에 잘 용해됩니다.
▶ 이온은 기본적으로 극성입니다. 왜냐하면...
이온은 전하를 띠고 있기 때문입니다.
---------------------------------------------------
극성 분자란 것들은 (또는 쌍극자를 가진 것들은)
δ+, δ–, 즉 부분 양전하, 부분 음전하를 가진 것들입니다.
( 한 몸 안에, 두 전하를 동시에... )
반면에, 이온님들께서는,
완전한(온전한) + 또는 –, 즉 양전하 또는 음전하를
독립적으로, 홀로, 따로 가지신 분들입니다.
[주의] 극성/무극성과 전기적 중성은 구별하세요.
극성 분자와 이온결합 물질은, 둘 다 전기적으로는 중성입니다.
이런 상태이기 때문에, 극성 분자는 이온님과
극성 정도를 감히 비교조차 할 수 없는 미천한 신분입니다.^^
즉, 극성 분자의 극성 정도는 이온의 극성에 비하면,
조족지혈(새 발의 피)입니다.
[도표] 몇 가지 화합물의 쌍극자 모멘트
NaCl의 쌍극자 모멘트와 물의 쌍극자 모멘트를 비교해 보세요.
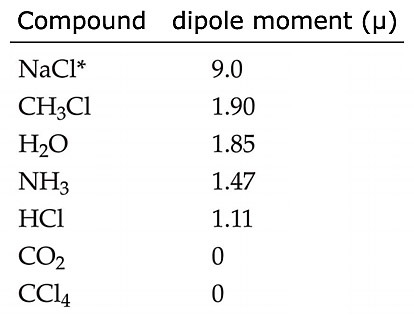
*NaCl은 기체 상태에서 측정.
( 참고: NaCl 기체 분자 https://ywpop.tistory.com/10685 )
[키워드] 암모늄 기준, NH4^+ 기준, 이온은 극성 물질 기준, 이온은 극성 기준, 이온결합 화합물은 극성 물질 기준, 이온결합 물질은 극성 물질 기준, 이온결합 화합물은 극성 기준, 이온결합 물질은 극성 기준, 암모늄 사전, NH4^+ dic, 이온은 극성 물질 사전, 이온은 극성 사전, 이온결합 화합물은 극성 물질 사전, 이온결합 물질은 극성 물질 사전, 이온결합 화합물은 극성 사전, 이온결합 물질은 극성 사전
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 이온 결합 화합물과 분자 화합물 구별 (3) | 2015.04.13 |
|---|---|
| 격자 에너지. Lattice Energy. CaCl2 ★ (1) | 2015.01.05 |
| 격자 에너지. Lattice Energy. NaCl ★ (0) | 2015.01.05 |
| 3가지 화학 결합 ★ (1) | 2014.11.29 |
| 루이스 전자 점 기호로 나타낸 주기율표 (1) | 2014.10.13 |
| 공명 구조. resonance structures ★ (0) | 2014.06.26 |
| 팔전자 규칙. 옥텟 규칙. octet rule ★ (3) | 2014.06.26 |
| 일산화탄소(carbon monoxide, CO)의 작은 쌍극자 모멘트(dipole moment) (1) | 2014.06.25 |



댓글