728x170
Fe^3+/Fe^2+ 및 Cu^2+/Cu 전지의 표준기전력
Fe^3+/Fe^2+ 및 Cu^2+/Cu^0로 구성되어 있는
가상전지에서 얻을 수 있는 전위는?
단, 표준환원전위는 다음과 같다.
Fe^3+ + e^- → Fe^2+ ... E° = 0.771 V
Cu^2+ + 2e^- → Cu^0 ... E° = 0.337 V
---------------------------------------------------
E°cell = E°red(환원전극) – E°red(산화전극)
= (환원된 물질의 표준환원전위) – (산화된 물질의 표준환원전위)
( 참고 https://ywpop.tistory.com/4558 )
= (0.771 V) – (0.337 V)
= 0.434 V
답: 0.434 V
[참고] 기전력은 세기 성질
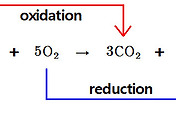
Q. Cu + 2Fe^3+ → Cu^2+ + 2Fe^2+, 이렇게 계수를 맞춰서,
즉 주고받은 전자수를 맞춰서 전위를 계산하지 않는 이유는?
A. 표준 환원 전위 도표에 나오는 반응식의 계수와
실제 반쪽 전지 반응식의 계수가 달라도
전극 전위는 동일하다.
왜냐하면, 전극 전위는 양에 무관한 세기 성질이기 때문이다.
( 참고 https://ywpop.tistory.com/8309 )
[주의] 단, Nernst 식을 사용할 경우에는
n과 Q 값을 구하기 위해서
각 반쪽 전지 반응식의 계수를 맞춰야 된다.
( 참고 https://ywpop.tistory.com/2900 )
반응형
그리드형(광고전용)
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| redox balance. SO3^2- + MnO4^- → SO4^2- + Mn^2+ (0) | 2022.04.18 |
|---|---|
| redox balance. Fe2O3 → Fe + O2 (0) | 2022.04.17 |
| redox balance. C3H8 + O2 → CO2 + H2O (0) | 2022.04.14 |
| redox balance. NO2 → NO3^- + NO (acidic) (0) | 2022.04.08 |
| 0.1 M Fe^2+ 50 mL를 0.1 M Tl^3+로 적정. 당량점에서 전위(V) (2) | 2022.02.26 |
| redox K2Cr2O7 + SnCl2 (0) | 2022.02.14 |
| 산화수법. MnO4^- + Cl^- + H^+ → Mn^2+ + Cl2 + H2O (0) | 2022.02.05 |
| 기전력과 평형상수 Cd + Sn^2+ (0) | 2022.01.29 |
댓글