용액의 성질. 끓는점 오름과 어는점 내림
---------------------------------------------------
▶ 참고: 제13장 용액의 성질. 목차
[ https://ywpop.tistory.com/15289 ]
---------------------------------------------------
A. 끓는점오름. Boiling-point elevation
▶ 용액의 끓는점은 순수한 용매의 끓는점보다 높다.
끓는점 오름(ΔTb) = 용액의 끓는점 – 순수한 용매의 끓는점
( 용액의 끓는점 = 순수한 용매의 끓는점 + ΔTb )

ΔTb = Kb × m
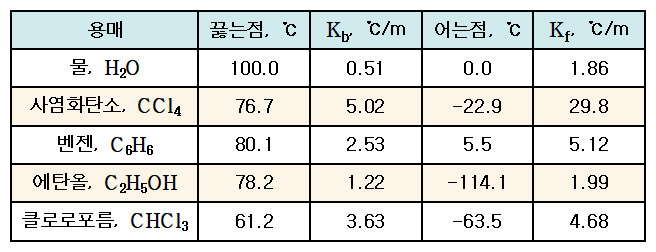
> Kb: 몰랄 끓는점 오름 상수. 용매에만 의존
( molal boiling-point-elevation constant )
( 예: 물의 몰랄끓는점오름상수 = 0.51 ℃/m )
> m: 용액의 몰랄농도
( 참고: 몰랄농도의 정의 https://ywpop.tistory.com/2667 )
전해질 용액일 경우,
ΔTb = i × Kb × m
( i = van't Hoff 인자 = 용액 속에 존재하는 전체 이온의 몰수 )
( 참고: 반트호프 인자 https://ywpop.tistory.com/2648 )
예) NaCl(aq) → Na^+(aq) + Cl^-(aq) ... i = 2
예) Na3PO4(aq) → 3Na^+(aq) + PO4^3-(aq) ... i = 4
[ van't Hoff 인자 관련 글 https://ywpop.tistory.com/search/van't%20Hoff ]
[ 관련 예제 https://ywpop.tistory.com/18798 ] 0.5 M 수용액의 끓는점이 가장 높은 것
① C6H12O6(포도당) ② C12H22O11(설탕) ③ CaCl2(염화칼슘) ④ NaCl(염화나트륨)
B. 어는점내림. Freezing-point depression
▶ 용액의 어는점은 순수한 용매의 어는점보다 낮다.
어는점 내림(ΔTf) = 순수한 용매의 어는점 – 용액의 어는점
( 용액의 어는점 = 순수한 용매의 어는점 – ΔTf )
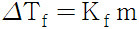
ΔTf = Kf × m
> Kf: 몰랄 어는점 내림 상수. 용매에만 의존
( molal freezing-point-depression constant )
( 예: 물의 몰랄어는점내림상수 = 1.86 ℃/m )
전해질 용액일 경우,
ΔTf = i × Kf × m
( i = van't Hoff 인자 )
[표] 몇 가지 용매의 몰랄끓는점오름상수와 몰랄어는점내림상수
[예제] 끓는점오름상수와 어는점내림상수는 다음 중 어느 것에 의존하는가?
ㄱ. 용질의 농도
ㄴ. 용질의 성질
ㄷ. 용매의 성질 (○)
[예제] 다음 각 수용액의 농도가 0.5 M일 때,
① NaCl(s) + H2O(l) → Na^+(aq) + Cl^-(aq) ... i = 2
② NaNO3(s) + H2O(l) → Na^+(aq) + NO3^-(aq) ... i = 2
③ CaCl2(s) + H2O(l) → Ca^2+(aq) + 2Cl^-(aq) ... i = 3
④ C6H12O6(s) + H2O(l) → C6H12O6(aq) ... i = 1
---> 0.5 M CaCl2 수용액의 끓는점이 가장 높다.
---> 0.5 M CaCl2 수용액의 어는점이 가장 낮다.
( ①, ②, ③은 전해질, ④는 비전해질. )
▶ 혼합물의 끓는점오름: 된장국
> 같은 양의 된장국과 물을 끓일 때
된장국이 끓기 시작하는 온도가 물의 끓는점보다 더 높으므로,
된장국이 나중에 끓는다.
▶ 혼합물의 어는점내림: 땜납
> 용접할 때 사용하는 땜납(납 + 주석)은
혼합물의 녹는점이 순물질보다 낮은 성질을 이용한 것이다.
[ 관련 예제 https://ywpop.tistory.com/22433 ] 21.2 g NaCl + 135 mL water 용액의 끓는점과 어는점
[ 관련 예제 https://ywpop.tistory.com/22434 ] 15.4 g 요소 + 66.7 mL water 용액의 끓는점과 어는점
[키워드] 일반화학 13장 용액의 성질-2, 총괄성 기준문서, 반트호프 인자 기준문서, 끓는점오름 기준문서, 어는점내림 기준문서, 끓는점 오름 사전, 어는점 내림 사전, 어는점내림 사전, 어는점 내림 기준문서
'일반화학 > [13장] 용액의 성질' 카테고리의 다른 글
| 벤젠과 톨루엔의 액체 혼합물에서 벤젠 증기의 몰분율 (1) | 2015.06.19 |
|---|---|
| 비휘발성, 비전해질 물질 15 g 물 500 g 0.26℃ (2) | 2015.06.07 |
| 삼투압. 고분자 분자량 측정 (1) | 2015.04.27 |
| 삼투압과 몰질량(분자량). osmotic pressure equation (0) | 2014.12.09 |
| 물에 NaCl 1 mol의 첨가는 글루코스 1 mol보다 증기압력을 더 낮게 한다 (0) | 2014.10.15 |
| 총괄성, 총괄 성질. 반트호프 인자 ★ (4) | 2014.06.30 |
| 증기압 내림과 라울(Raoult)의 법칙 ★ (4) | 2014.06.30 |
| 삼투현상과 삼투압. osmosis and osmotic pressure ★ (3) | 2012.09.13 |




댓글