몰농도(molarity, M), 몰랄농도(molality, m)
몰농도와 몰랄농도
---------------------------------------------------
▶ 참고: 용액의 농도 표시법
[ https://ywpop.tistory.com/2655 ]
---------------------------------------------------
교과서적으로 정의를 내리면,
즉 책에 나오는 정의는 다음과 같다.
> 몰농도(M): 용액 1 L에 용해되어있는 용질의 mol수
> 몰랄농도(m): 용매 1 kg에 용해되어있는 용질의 mol수
( 학교 시험에서 정의를 물으면, 이렇게 답해야 한다. )
▶ (필자의) 몰랄농도의 정의
> 용매 1 kg당 용해되어있는 용질의 mol수
몰랄농도는 용매 1 kg과 함께 존재하는 용질의 mol수를 나타낸 농도이다.
흔히들 용매 1 kg에 용해되어있는 용질의 mol수라고 잘못 알고 있는데,
용매는 용매이고, 용질은 용질이다.
순물질인 용매 속에 순물질인 용질이 존재할 수 없다.
용액 속에 용매도 존재하고, 용질도 존재하는 것이다.
즉, 용매나 용질은 용액(균일 혼합물)을 구성하는
각각의 독립적인 성분(순물질)이다.
용액 = 용매 성분 + 용질 성분
( 참고: 용액론 https://ywpop.tistory.com/40 )
그러나 위의 정의들은 농도를 계산할 때, 바로 와닿지 않는다.
즉, 위의 정의들 갖고는 농도를 바로 계산할 수 없다.
예를 들어,
“용액이 1 L, 또는 용매가 1 kg이 아닐 땐 어떻게 계산하지?”
이렇게 생각할 수 있으므로, 농도 계산이 혼란스럽다.
필자가 설명하는 몰농도의 정의는
“용질 mol수 / 용액 L수” 이다.
이렇게 정의내리면, 몰농도를 계산할 때,
용질의 mol수와 용액의 L수를 각각 구해서
몰농도의 정의 그대로
“용질 mol수 나누기 용액 L수” 하면 된다.
또한
몰랄농도의 정의는
“용질 mol수 / 용매 kg수” 이며,
몰랄농도 계산은
용질의 mol수와 용매의 kg수를 각각 구해서
“용질 mol수 나누기 용매 kg수” 하면 된다.


※ 용질의 mol수 = 용질의 질량(W) / 용질의 몰질량(M)
( 참고: n = W / M https://ywpop.tistory.com/7738 )
[ 관련 글 https://ywpop.tistory.com/3222 ] 몰농도의 정의를 이용한 몰농도 계산
[ 관련 글 https://ywpop.tistory.com/1914 ] 몰농도 ↔ 몰랄농도 환산
▶ 몰농도는 온도에 따라 변한다. (∵ 분모가 부피)
▶ 몰랄농도는 온도에 따라 거의 변하지 않는다. (∵ 분모가 질량)
▶ (많이) 묽은 (수)용액에서, 몰농도 ≒ 몰랄농도
용매 1000 g + 용질 1 g
= 용액 1001 g ≒ 용매 1000 g ≒ 용액 1000 mL
예제) 몰농도/몰랄농도 계산
물 25 mL에 글루코스 4.35 g을 용해시켰다.
이 용액의 몰농도와 몰랄농도를 계산하시오.
단, 용액의 밀도는 용매의 밀도와 같다고 가정한다.

해설) 실제 용액의 밀도는 물의 밀도보다 크므로,
이 용액의 몰농도는 0.821 보다는 크고, 0.946 보다는 작을 것이다.
[ 관련 예제 https://ywpop.tistory.com/16529 ] 45% 황산 용액(d 1.40)의 몰농도와 몰랄농도
[ 관련 예제 https://ywpop.tistory.com/8585 ] 19% 염산 용액(d 1.17)의 몰농도와 몰랄농도
[팁] 동일 용액의 경우,
몰랄농도 > 몰농도
또는
몰랄농도 ≒ 몰농도
( 참고 https://ywpop.tistory.com/3775 )
따라서, 만약,
몰랄농도 < 몰농도 이면,
계산을 잘못한 것이다.
[참고] 몰랄농도는 분모의 단위가 질량이므로,
만들고자 하는 용액의 양이 부피 단위이면,
정확한 부피로는 만들 수 없다.
[ 관련 예제 https://ywpop.tistory.com/13040 ] 0.05 m NaOH 용액 만들기
[키워드] 몰농도 기준, 몰농도의 정의 기준, 몰랄농도 기준, 몰랄농도의 정의 기준, 몰농도 사전, 몰농도의 정의 사전, 몰랄농도 사전, 몰랄농도의 정의 사전, 몰농도와 몰랄농도 기준, 몰농도와 몰랄농도 사전, 몰농도 경전, 몰랄농도 경전
'화학 > 용액의 농도' 카테고리의 다른 글
| 산-염기의 노르말농도(Normality, N) ★ (1) | 2014.12.18 |
|---|---|
| 물의 몰농도(M)는 55.6 M. Molarity of Water (1) | 2014.12.15 |
| 같은 질량의 글리세롤(C3H8O3)과 물을 포함하는 용액의 농도 (0) | 2014.10.09 |
| 98% 황산 용액의 몰농도 (d 1.84) ★ (4) | 2014.10.04 |
| 몰분율 (mole fraction) ★ (3) | 2014.07.04 |
| 백만분율(ppm), 십억분율(ppb) ★ (6) | 2014.07.03 |
| 질량 백분율 (퍼센트 농도) ★ (2) | 2014.07.03 |
| 몰농도(M) 몰랄농도(m) 환산(변환) ★ (0) | 2012.09.11 |
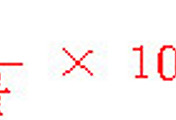


댓글