728x170
몰랄농도는 몰농도보다 값이 크다
어떤 용액의 몰랄농도는 몰농도보다 값이 크다.
▶ 참고: 몰농도(molarity, M), 몰랄농도(molality, m)
[ https://ywpop.tistory.com/2667 ]
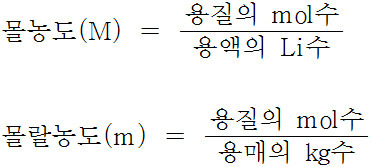
몰농도 = 용질 mol수 / 용액 L수
---> 몰농도는 분모가 용액의 양.
몰랄농도 = 용질 mol수 / 용매 kg수
---> 몰랄농도는 분모가 용매의 양
일반적으로 용액의 양 > 용매의 양 이므로,
( 용액의 양 = 용질의 양 + 용매의 양 )
분모의 값이 더 작은 몰랄농도의 값이 몰농도보다 더 크다.
( 계산 예 https://ywpop.tistory.com/9946 )
진한 용액일수록,
용매의 양은 더욱더 감소하므로,
몰랄농도의 값은 훨씬 더 커진다.
( 계산 예 https://ywpop.tistory.com/9668 )
[ 관련 글 https://ywpop.tistory.com/5412 ] 매우 묽은 용액에서, 용액의 몰농도 ≒ 몰랄농도
[ 관련 글 https://ywpop.tistory.com/3344 ]
[ 관련 글 https://ywpop.tistory.com/17764 ] 0.20 M, 0.20 m 설탕 용액 중 더 진한 용액
[키워드] 몰농도와 몰랄농도 기준문서, 몰농도 몰랄농도 기준문서, 매우 묽은 용액 기준문서
반응형
그리드형(광고전용)
'화학 > 용액의 농도' 카테고리의 다른 글
| 70% 질산(d 1.41)의 몰농도 (1) | 2019.05.10 |
|---|---|
| CuSO4*5H2O 시약으로 0.2 M CuSO4 용액 1 L 만들기 (0) | 2019.05.07 |
| 75.0 mL 에탄올(d 0.79)을 포함하는 용액 250.0 mL의 몰농도 (0) | 2019.04.28 |
| 수용액의 질량비가 1.704 kg HNO3/kg H2O (1) | 2019.04.27 |
| 1000 mg/L Hg 표준용액 100 mL 제조에 필요한 염화수은(HgCl2) (0) | 2019.04.22 |
| 질산의 밀도 도표. density of nitric acid, HNO3 (1) | 2019.04.15 |
| 28% 암모니아수(d 0.899, FW 17.03)로 0.250 M NH3 용액 500 mL 만들기 ★ (0) | 2019.04.05 |
| 98% 황산(d 1.84, FW 98.08) 시약으로 1 N H2SO4 용액 250 mL 만들기 ★ (1) | 2019.04.04 |
댓글