용액의 몰랄농도는 몰농도보다 크다
같은 상태의 용액에서 몰랄농도가 몰농도보다 크다고 배웠는데,
원리 좀 알려주세요.
---------------------------------------------------
몰농도와 몰랄농도의 정의는 다음과 같습니다.
▶ 몰농도 = 용질 mol수 / 용액 L수
▶ 몰랄농도 = 용질 mol수 / 용매 kg수
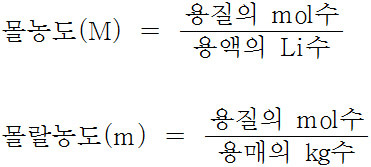
용액과 용매의 밀도가 같다고 가정하면,
다음과 같이 설명할 수 있습니다.
과일 바구니에 사과가 2 kg, 배가 8 kg 들어있습니다.
이 과일 바구니에 들어 있는 사과의 농도를
몰농도와 몰랄농도로 비유해서 설명하면,
( 사과=용질, 배=용매, 사과+배=용액 )
( 용질의 mol수와 질량은 비례하므로,
mol수 대신 질량을 그대로 사용하겠습니다. )
몰농도는
사과 2 kg / (사과 2 kg + 배 8 kg)
= 2 / 10 = 0.20 M
몰랄농도는
사과 2 kg / 배 8 kg
= 2 / 8 = 0.25 m
이렇게 계산해보면 알 수 있습니다.
( 보통 용액의 밀도는 용매의 밀도보다 크므로,
실제 몰농도는 0.20 M 보다는 크고, 0.25 M 보다는 작습니다. )
[ 관련 글 https://ywpop.tistory.com/11171 ]
[ 관련 글 https://ywpop.tistory.com/17764 ] 0.20 M, 0.20 m 설탕 용액 중 더 진한 용액
[키워드] 몰농도와 몰랄농도 기준문서
'화학 > 용액의 농도' 카테고리의 다른 글
| 60% 질산(HNO3) 용액 675 mL의 묽힘 (0) | 2015.06.29 |
|---|---|
| 포도주는 부피로 12.5% 에탄올. 에탄올의 질량 백분율과 몰랄농도 (0) | 2015.06.17 |
| 40.0% 에틸렌 글리콜 수용액의 몰분율, 몰농도, 몰랄농도 (0) | 2015.06.16 |
| 33.33% 황산 용액(d 1.25)의 몰분율, 몰농도, 몰랄농도, 노르말농도 (0) | 2015.06.15 |
| 0.1050 M Na2CO3 17.5 mL 0.1250 M NaCl 46.0 mL (0) | 2015.04.20 |
| 몰농도의 정의와 계산 방법 ★ (4) | 2015.03.13 |
| 37% 염산의 몰농도(M) (7) | 2015.03.10 |
| 퍼센트농도. w/w, v/v, w/v and v/w mean? ★ (0) | 2015.01.22 |

댓글