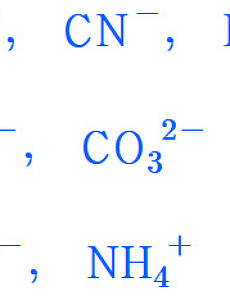 이온의 종류. 단원자 이온과 다원자 이온
이온의 종류. 단원자 이온과 다원자 이온 --------------------------------------------------- ▶ 참고: 이온의 정의 [ https://ywpop.tistory.com/5501 ] --------------------------------------------------- ▶ 단원자 이온. monatomic ion > 단 1개의 원자로 이루어진 이온 예1) H^+, Na^+, K^+, Mg^2+, Ca^2+, Al^3+ 등 양이온 예2) F^-, Cl^-, O^2-, S^2-, N^3-, P^3- 등 음이온 ( 참고 https://en.wikipedia.org/wiki/Monatomic_ion ) ▶ 다원자 이온. polyatomic ion > 2개 이상의 원자로 ..
2022. 8. 30.
이온의 종류. 단원자 이온과 다원자 이온
이온의 종류. 단원자 이온과 다원자 이온 --------------------------------------------------- ▶ 참고: 이온의 정의 [ https://ywpop.tistory.com/5501 ] --------------------------------------------------- ▶ 단원자 이온. monatomic ion > 단 1개의 원자로 이루어진 이온 예1) H^+, Na^+, K^+, Mg^2+, Ca^2+, Al^3+ 등 양이온 예2) F^-, Cl^-, O^2-, S^2-, N^3-, P^3- 등 음이온 ( 참고 https://en.wikipedia.org/wiki/Monatomic_ion ) ▶ 다원자 이온. polyatomic ion > 2개 이상의 원자로 ..
2022. 8. 30.