베릴륨 화합물. BeF2, BeCl2는 공유결합 물질
[참고] 제8장 화학 결합의 기본 개념. 목차
[ https://ywpop.tistory.com/15249 ]
▶ BeCl2의 전기음성도 차이 = 3.0 – 1.5 = 1.5
( 참고: 전기음성도 https://ywpop.tistory.com/2567 )
▶ BeF2의 전기음성도 차이 = 4.0 – 1.5 = 2.5
---> BeF2는 전기음성도 차이가 1.8 이상임에도 불구하고,
공유결합을 형성한다.
---> Why?
금속 원자의 이온 성질(ionic nature)은
금속 원자의 크기에 비례하여 증가합니다.
즉, 금속 원자는 크기가 클수록 전자를 잘 잃습니다.
원자핵과 최외각전자 간 거리가 멀어지기 때문에 그렇습니다.
( 금속의 이온화 에너지는 주기율표 아래로 내려갈수록 감소. )
( 참고: 이온화 에너지 https://ywpop.tistory.com/10684 )
베릴륨(beryllium)은 알칼리토금속(2A족) 중에서
원자 크기가 가장 작습니다. 크기가 작기 때문에,
원자핵과 최외각전자 간 거리가 가까워서,
베릴륨의 원자핵은 자신의 최외각전자를 강하게 끌어당기고 있습니다.
이 때문에 베릴륨은 전자를 잃고 양이온이 되는 것이 쉽지 않습니다.
이와 같은 이유 때문에 베릴륨은 전자를 잃는 대신,
다른 원자와 전자를 공유함으로써 화합물을 형성합니다.
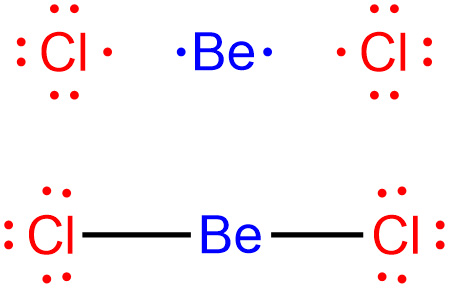
[그림] BeCl2의 루이스 구조.
[참고] BeCl2의 극성. BeCl2 polar or nonpolar
> 직선형, 대칭 구조이므로,
BeCl2는 무극성 분자이다.
[ Why BeF2 and BeCl2 are covalent not ionic: Fajans' rule ]

[그림] BeF2의 루이스 구조.
[참고] Beryllium fluoride is the inorganic compound with the formula BeF2. This white solid is the principal precursor for the manufacture of beryllium metal. Its structure resembles that of quartz, but BeF2 is highly soluble in water.
[ https://en.wikipedia.org/wiki/Beryllium_fluoride ]
---------------------------------------------------
2주기 금속 원자(Li와 Be)의 이온성을 고려할 때는
유효 핵전하( https://ywpop.tistory.com/2526 )와
이온화 에너지, 둘 다를 동시에 고려해야 합니다.
▶ 공유 결합과 이온 결합을 구분할 때,
전기음성도 차이는 일반적인(단순한, 간편한) 도구일 뿐,
절대적인 기준 잣대는 아니다.
[ 관련 글 https://ywpop.tistory.com/7655 ]

[그림] Lewis structure of BeH2, beryllium hydride.
[ 관련 글 https://ywpop.tistory.com/21272 ]
금속인 베릴륨과 붕소가 공유결합 화합물을 형성하는 이유
[키워드] 베릴륨 기준, 베릴륨 화합물 기준, BeCl2 루이스 기준, BeF2 루이스 기준, BeH2 루이스 기준, BeCl2 루이스 구조 기준, BeF2 루이스 구조 기준, BeH2 루이스 구조 기준, BeF2 dic, BeCl2 dic
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 격자에너지. KCl MgO. MgO KCl (0) | 2017.11.30 |
|---|---|
| HNO3의 루이스 구조와 형식전하. HNO3의 산화수 (0) | 2017.10.07 |
| 배위 공유 결합. NH4^+와 H3O^+ (1) | 2017.10.05 |
| 단일결합과 다중결합의 결합세기(결합힘, 결합에너지) (0) | 2017.10.04 |
| N2O 루이스 구조 그리기 (1) | 2017.06.16 |
| 결합 에너지. 결합 엔탈피 ★ (0) | 2017.05.21 |
| CaCl의 격자에너지. 생성엔탈피 계산 ★ (1) | 2017.04.28 |
| 화학결합의 크기. 화학결합의 세기 ★ (1) | 2017.04.15 |




댓글