유효 핵전하. 원자가 전자와 핵심부 전자
Effective Nuclear Charge
---------------------------------------------------
▶ 참고: 유효 핵전하 도표
[ https://ywpop.tistory.com/2986 ]
---------------------------------------------------
유효 핵전하를 이해하기 위해서는, 먼저,
‘원자가 전자’와 ‘핵심부 전자’를 구분할 줄 알아야 한다.
▶ 원자가 전자. Valence Electron
> 원자의 가장 바깥 전자껍질에 존재하는 전자 (빨강색)
( 참고: 원자가 전자 https://ywpop.tistory.com/10468 )
▶ 핵심부 전자. Core Electron
> 원자가 전자를 제외한 나머지 전자,
즉 안쪽 전자껍질에 존재하는 전자 (파랑색)

[그림] 원자가 전자와 핵심부 전자.
▶ 원자의 전체 전자 수 = [핵심부 전자 수] + [원자가 전자 수]
▶ 전자의 핵전하(Nuclear Charge)
> 전자가 느끼는(감지하는) 원자핵의 양(+)전하
다(多)전자 원자에서,
각 전자는 ①원자핵에는 끌리고, ②전자들끼리는 서로 반발한다.
따라서 전자의 핵전하는 ①인력, ②반발력, 2가지 인자에 의존한다.

[그림] 핵심부 전자에 의한 차폐(shielding).
차폐를 가리움 효과(screening effect)라고도 한다.
‘핵심부 전자’가 ‘원자핵’과 ‘원자가 전자’ 사이의 인력을 차단(방해)하고 있다.
이 때문에, 원자가 전자는 실제 핵전하를 전부 느낄 수 없다.
[참고] 원자가 전자가 핵전하를 느낀다.
> 원자가 전자 = 전자 = 음의 전하(–)를 가진 물질
> 원자핵 = 양의 전하(+)를 가진 물질
---> 원자가 전자가 원자핵의 핵전하를 느낀다.
= 음전하(–)인 원자가 전자가
원자핵의 양전하(+)를 느낀다.
= 음전하(–)인 원자가 전자가
원자핵의 양전하(+)에 이끌린다.
= 음전하(–)인 원자가 전자와
양전하(+)인 원자핵 사이에 정전기적 인력이 작용한다.
▶ 유효 핵전하, Z_eff
> 다전자 원자에서, 원자가 전자(Valence Electron)가 느끼는 핵전하
유효 핵전하는 다음 식으로 근사값을 계산할 수 있다.

[1]식을 보면,
유효 핵전하(Z_eff)는 가려막기 상수(S) 만큼 감소하는데,
S는 핵심부 전자의 수와 밀접한 관계가 있다(비례한다).
정확한 S 값을 사용하여, 정확한 Z_eff 값을 계산할 수 있지만,
( 참고 https://ywpop.tistory.com/2986 )
S = [핵심부 전자 수] 로 가정하여,
간단히 Z_eff 값을 계산할 수도 있다.
S = [핵심부 전자 수] 를 [1]식에 대입하면,
다음과 같이 원자가 전자의 Z_eff를 계산할 수 있다.
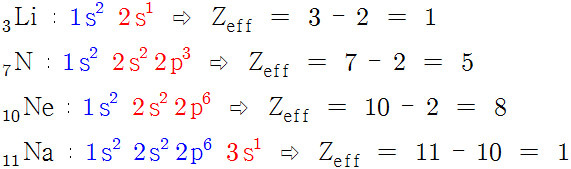
자세히 살펴보면,
중성 원자의 Z_eff는 원자가 전자 수와 같음을 알 수 있다.
그렇다고, 단순히 Z_eff = [원자가 전자 수] 라고 외우면 곤란하다.
다음과 같이 이온일 경우에는 상황에 따라 달라지기 때문이다.

---------------------------------------------------
(원자가 전자의) 유효 핵전하의 주기적 경향
주기율표에서,

[참고] 같은 족의 경우, [양성자 수 – 핵심부 전자 수] 는 동일하지만,
실제 핵전하(= 양성자 수)가 증가하기 때문에, Z_eff는 약간이마나 증가한다.
주기율표의 같은 주기에서 원자번호가 증가할수록(오른쪽으로 갈수록)
원자의 유효 핵전하는 증가하며, 이로 인해 원자의 이온화 에너지도 증가한다.
유효 핵전하가 증가하면, 원자핵과 원자가전자 사이의 인력이 증가하고,
인력이 증가하는 만큼 전자를 떼어내기 힘들 테니까,
원자에서 전자를 제거하는데 필요한 에너지인 이온화 에너지도 증가하는 것이다.
[중요] 유효 핵전하의 주기적 경향성은 주의해야 한다.
원자 반지름 또는 이온화 에너지의 주기적 경향성과는 다르다.
같은 주기에서는 왼쪽에서 오른쪽으로 갈수록 증가하고,
같은 족에서는 위에서 아래로 내려갈수록 ‘조금’ 증가한다.
---------------------------------------------------
[원자의 크기, 원자 반지름]
▶ “원자 크기”의 정의
> 원자핵 주위를 돌아다니는 전자가 차지하는 공간의 90%까지

주기율표에서,
왼쪽(←)으로 갈수록, (∵ 유효 핵전하 감소)
아래(↓)로 갈수록, (∵ 껍질, 즉 주양자수 증가)
원자 반지름은 증가한다.
( 반면에, 이온화 에너지는 감소한다. )
유효 핵전하가 증가한다는 말은 핵이 전자를 단속하는 힘도 증가한다는 말.
따라서 전자는 핵에 의해 강하게 구속되므로, 반지름은 감소한다.
[이온화 에너지의 경향성]

큰 힘(에너지) 쓰지 않고도 전자를 떼어낼 수 있다.
→ 전자를 잃고 양이온이 되기 쉽다.
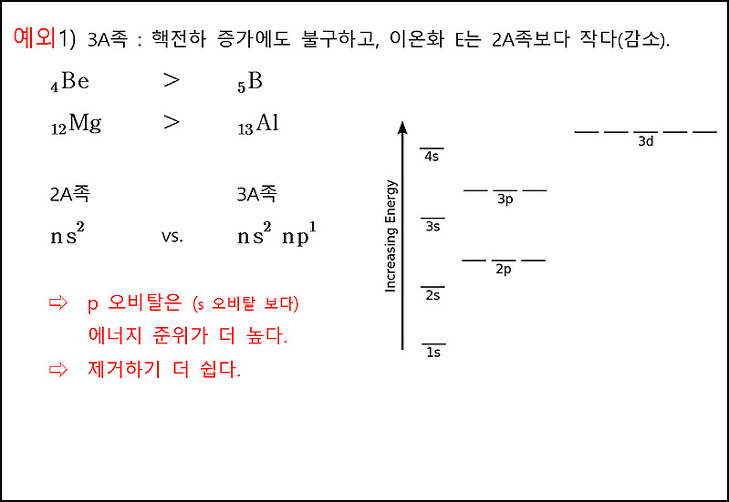
이온화 에너지 경향성 예외. 3A족.
( 추가 설명 https://ywpop.tistory.com/4266 )

이온화 에너지 경향성 예외. 6A족.
[ 관련 글 https://ywpop.tistory.com/5696 ] 전자 친화도 도표
[ 관련 글 https://ywpop.tistory.com/7147 ] 원자 및 이온의 반지름 결정 방법
[키워드] 주기율표 원자 반지름 경향성 기준문서, 주기율표 원자 크기 경향성 기준문서, 원자 반지름 기준문서, 원자 크기 기준문서, 주기율표 이온화 에너지 경향성 기준문서, 이온화 에너지 기준문서, 유효 핵전하 기준문서, 이온화 에너지 사전, 유효 핵전하 사전, 핵심부 전자 기준문서, 핵심부 전자 사전, 가리움 효과 기준, 가리움 효과 사전
'일반화학 > [07장] 원소의 주기적 성질' 카테고리의 다른 글
| 모든 원소의 전자 친화도(electron affinity)는 항상 +값일까? (4) | 2016.08.18 |
|---|---|
| 알칼리 금속과 물의 반응. Alkali Metal-Water Reactions (0) | 2016.07.27 |
| 비활성 기체. noble gas atom? noble gas molecule? (1) | 2016.03.11 |
| 원자의 이온의 크기 ★ (0) | 2015.12.04 |
| 주기율표와 원소의 주기적 경향(성질). 이온화 에너지 (0) | 2015.11.16 |
| 알칼리 금속 화합물의 불꽃 반응, Flame test (0) | 2014.11.18 |
| 유효 핵전하, effective nuclear charge (1) | 2014.11.14 |
| 이온화 에너지와 전자 친화도 ★ (0) | 2014.11.03 |


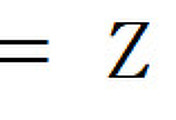

댓글