탄소의 동소체. 다이아몬드와 흑연
allotropes of carbon. diamond and graphite
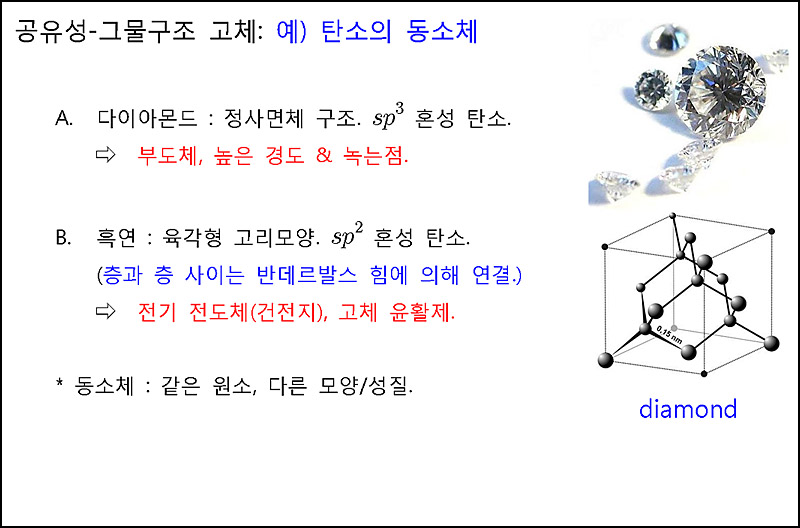
[ 그림 출처 commons.wikimedia.org ] Diamond and graphite samples.
( 참고: 흑연과 다이아몬드의 높은 끓는점 https://ywpop.tistory.com/8942 )

A1 = 다이아몬드, A2 = 흑연.
▶ 다이아몬드가 흑연보다 더 단단한 이유
> 다이아몬드는 보다 약한 sp^3 결합이지만,
고체 전체적으로 화학적으로 결합되어 있고,
흑연은 보다 강한 sp^2 결합이지만,
층과 층은 화학결합이 아닌
분자간 힘(분산력)으로 상호작용하고 있기 때문이다.
( 참고: 분산력 https://ywpop.tistory.com/2585 )
> 흑연은 sp^2 결합에 존재하는 파이전자 때문에
좋은 전기 전도체가 되고,
층과 층 사이의 약한 분산력 때문에
층과 층이 잘 미끄러져 좋은 고체 윤활제가 된다.
▶ 다이아몬드는 sp^3 탄소이므로, 단일결합 (–C–C–C–C–),
흑연은 sp^2 탄소이므로, 단일결합+이중결합 (–C=C–C=C–).
> 다중결합일수록, 결합세기는 증가한다.
( 참고: 결합 엔탈피 https://ywpop.tistory.com/2558 )
▶ 단일결합보다 다중결합의 세기가 더 강하다?
이 이유는 과학보다는 상식에 가깝다.
A와 B는 상대방과 한 팔로 잡고 있고, ( A–B )
C와 D는 상대방과 양 팔로 잡고 있다. ( C=D )
같은 힘으로 각각 양쪽을 잡아 당겼을 때,
( ⇚ A–B ⇛ vs. ⇚ C=D ⇛ )
어느 쪽이 보다 쉽게(빨리) 떨어질까?
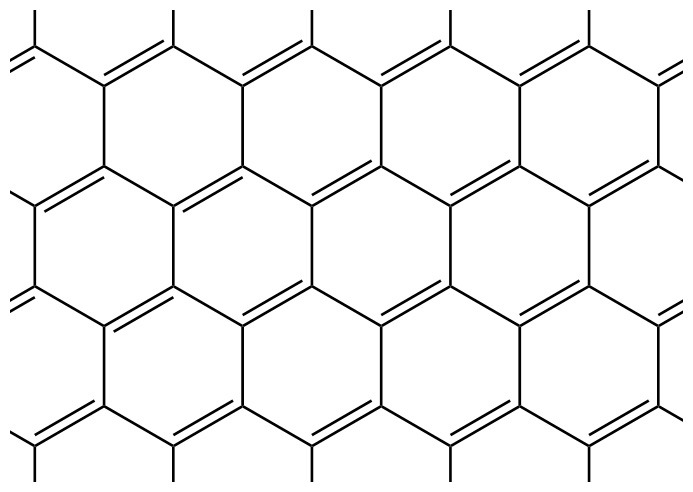
[그림] graphite structure.
sp^2 탄소는
3개의 시그마결합, 1개의 파이결합을 갖기 때문에,
이중결합을 가진다.
▶ 흑연이 다이아몬드보다
원자간 결합 힘이 더 크므로 (더 강하므로)
흑연은 다이아몬드보다 화학적으로 더 안정한 물질이다.
▶ 이중결합에 존재하는 π-전자 때문에 흑연은 전기 전도체이고,
π-전자가 없는 다이아몬드는 전기 부도체이다.

[ 그림 출처 commons.wikimedia.org ] Eight Allotropes of Carbon.
a) Diamond
b) Graphite
c) Lonsdaleite
[ https://en.wikipedia.org/wiki/Lonsdaleite ]
d) C60 (Buckminsterfullerene)
e) C540 (see Fullerene)
f) C70 (see Fullerene)
g) Amorphous carbon: 석탄(coal), 그을음 또는 검댕(soot)
[ https://en.wikipedia.org/wiki/Amorphous_carbon ]
h) single-walled carbon nanotube
[ 관련 글 https://ywpop.tistory.com/7668 ] 흑연, 풀러렌, 탄소 나노튜브, 그래핀
[ 관련 글 https://ywpop.tistory.com/9978 ] 풀러렌(C60)과 다른 탄소 동소체의 공통점과 차이점
[키워드] 흑연과 다이아몬드 기준, 흑연의 구조식 기준, 탄소 동소체 기준, 흑연과 다이아몬드 사전, 탄소 동소체 사전, 흑연 사전
'화학' 카테고리의 다른 글
| 열용량과 비열. 수산화나트륨의 용해열 (0) | 2017.06.06 |
|---|---|
| 2.10 mol 용질의 몰농도(molarity) (0) | 2017.06.06 |
| 36% 염산(d 1.2 FW 36)으로 0.1 M HCl 용액 500 mL 만들기 (1) | 2017.06.05 |
| 수소 기체의 수상포집과 분압법칙. Mg + HCl (0) | 2017.06.05 |
| 열용량과 비열. 80℃ 구리금속 100 g을 20℃ 물 200 mL에 (2) | 2017.06.04 |
| 알짜이온반응식. K2SO4 + Pb(NO3)2 (0) | 2017.06.04 |
| 명명법. 6-ethyl-5-isopropyl-3-methyldecane (0) | 2017.06.03 |
| 용액의 묽힘. 0.25 M 용액을 0.025 M 용액으로 (2) | 2017.06.02 |

댓글