CHCl3는 극성인데, 물에 거의 용해되지 않는 이유
극성 분자인 클로로포름이 물에 잘 용해되지 않는 이유
극성 분자인 클로로포름이 물에 잘 녹지 않는 이유
극성 분자인 클로로포름이 물과 잘 섞이지 않는 이유
※ 일반적으로, 유기 화합물은 물에 잘 용해되지 않는다.
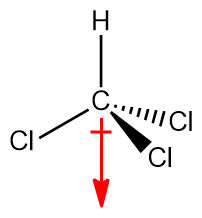
[그림] Dipole moment of CHCl3.
( 참고 https://ywpop.tistory.com/3745 )
극성 분자인 클로로포름이 물과 잘 섞이지 않는 이유는
클로로포름이 유기 화합물(유기물)이기 때문이다.
( 참고: 유기 화합물 https://ywpop.tistory.com/3204 )
클로로포름과 같은 유기 화합물은
비록 극성 물질이더라도 물에 대한 용해도는 매우 낮다.
기본적으로 유기물은
극성/무극성 상관없이, 물과 잘 섞이지 않는다.
또한 기본적으로 유기물은
극성/무극성 상관없이, 유기물끼리는 잘 섞인다.
왜냐하면,
유기물의 공통 원자단인 알킬기(R–)가 무극성인데,
이 알킬기가 유기물의 극성/무극성 성질에
큰 영향을 주기 때문이다.
( 참고: 알킬기 https://ywpop.tistory.com/6274 )
유기물이면서 물과 잘 섞이는 경우는,
① 메탄올(CH3–OH), 에탄올(CH3–CH2–OH)과 같이,
물과 수소 결합을 할 수 있는 물질에 한하며,
( 참고 https://ywpop.tistory.com/5585 )
설령 알코올 화합물이더라도, 알킬기가 많아지면,
예를 들면, CH3–CH2–CH2–CH2–OH,
이런 물질은 물과 잘 섞이지 않는다.
② 아세트산(CH3–COOH)과 같이,
물에서 이온화되는 유기산.
CH3–COOH(l) + H2O(l) → H3O^+(aq) + CH3–COO^-(aq)
( 참고 https://ywpop.tistory.com/6653 )
[ 관련 글 https://ywpop.tistory.com/3921 ] 극성인 아세톤과 무극성인 헥세인이 서로 섞이는 이유
[ 관련 글 https://ywpop.tistory.com/13193 ] solvent miscibility. C6H14 and CCl4
[ 관련 글 https://ywpop.tistory.com/12856 ] Solvent Miscibility Table
[ 관련 예제 https://ywpop.tistory.com/24349 ] 물에 대한 용해도가 가장 낮은 물질. CH3Cl
[키워드] 유기물의 물에 대한 용해도 기준, 유기 화합물의 물에 대한 용해도 기준, 유기물과 물의 혼합 기준, 유기 화합물과 물의 혼합 기준
'일반화학 > [24장] 생명의 화학: 유기화학과 생화학' 카테고리의 다른 글
| [작용기] 알데히드 (aldehyde), R-CHO (0) | 2016.11.23 |
|---|---|
| 알킬기(alkyl group). R– (0) | 2016.11.21 |
| [유기화학] 1차, 2차, 3차 알코올 (0) | 2016.10.17 |
| Nucleic acids, 핵산의 기본 단위, 구성 요소 (0) | 2016.10.12 |
| 탄화수소 화합물은 모두다 무극성인가? (0) | 2016.03.20 |
| 분자량으로 물질 검색 (0) | 2016.03.18 |
| 탄화수소 화합물의 분류, 종류 (4) | 2016.01.27 |
| 메탄올과 에탄올의 산화. oxidation of alcohols (2) | 2015.12.30 |



댓글