물에 대한 알코올의 용해도
Solubility of Alcohols
탄소 수가 증가할수록 물에 대한 알코올의 용해도는 감소하며,
( 프로판올까지는 물에 전부(무한대로) 용해됨 )
탄소 수가 7개 이상인 알코올은 물에 용해되지 않는 것으로 간주한다.
알킬기는 소수성(hydrophobic)이기 때문에,
( 참고: 알킬기 https://ywpop.tistory.com/6274 )
탄소 수가 증가할수록 물에 대한 알코올의 용해도는 감소한다.
[표1] Solubility in Water [g/100 mL of water]
| Name | Formula | Solubility |
| Methanol | CH3-OH | Infinite |
| Ethanol | C2H5-OH | Infinite |
| Propanol | C3H7-OH | Infinite |
| Butanol | C4H9-OH | 8.0 |
| Pentanol | C5H11-OH | 2.2 |
| Hexanol | C6H13-OH | 0.7 |
[표2] Solubility in Water [mol/100 g of H2O at 1 atm and 25 ℃]
| Name | Formula | Solubility |
| Methanol | CH3-OH | Infinite |
| Ethanol | C2H5-OH | Infinite |
| Propanol | C3H7-OH | Infinite |
| Butanol | C4H9-OH | 0.11 |
| Pentanol | C5H11-OH | 0.030 |
| Hexanol | C6H13-OH | 0.0058 |

[그림] Hydrogen-bonding alcohol-water interactions.
메탄올, 에탄올 등이 물에 잘 용해되는 이유는
메탄올-물 또는 에탄올-물 사이에
‘수소 결합’이 가능하기 때문이다.
( 참고: 수소결합 https://ywpop.tistory.com/2593 )
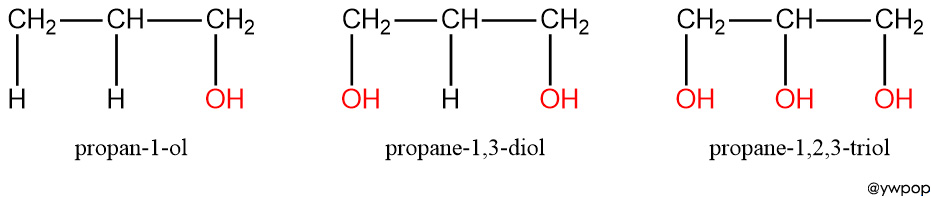
[그림] 1가 2가 3가 알코올.
물과 수소 결합할 수 있는 –OH 기가 증가한다.
= 물에 대한 용해도가 증가한다.
[ 관련 글 https://ywpop.tistory.com/3273 ] 물에서의 알코올의 용해도
[ 관련 글 https://ywpop.tistory.com/17368 ] 물에서의 탄화수소의 용해도
[ 관련 글 https://ywpop.tistory.com/5584 ] CHCl3는 극성인데, 물에 거의 용해되지 않는 이유
[키워드] 물에 대한 알코올의 용해도 기준, 알코올의 물에 대한 용해도 기준, 알코올 용해도 기준, 물에 대한 알코올의 용해도 사전, 알코올의 물에 대한 용해도 사전, 알코올 용해도 사전, 알코올 물 수소결합 기준, 메탄올 물 수소결합 기준, 에탄올 물 수소결합 기준, 알코올 수소결합 기준, 메탄올 수소결합 기준, 에탄올 수소결합 기준
'화학' 카테고리의 다른 글
| 10% 포도당(FW 180) 수용액의 몰랄농도 (0) | 2016.07.14 |
|---|---|
| 화학 당량. 어떤 금속(M) 8 g이 산소와 결합 (4) | 2016.07.13 |
| 기체 물질의 농도 환산. 830 μg/m3 SO2 and 90 μg/m3 CO (1) | 2016.07.12 |
| 이온 화합물, 이온성 화합물, ionic compound (0) | 2016.07.12 |
| 질산칼슘, Ca(NO3)2의 열분해 (0) | 2016.07.11 |
| 산-염기 중화반응. 0.2 M HCl + 0.1 M NaOH (0) | 2016.07.11 |
| [화학분석기능사] 0.1 M CH3COOH와 0.4 M NaOH의 산-염기 중화반응 (1) | 2016.07.10 |
| 산화-환원 반응. 산화된 물질과 환원된 물질이 주고받은 전자 수는 같다 (0) | 2016.07.09 |
댓글