4개 총괄성, 총괄 성질(colligative properties)
---------------------------------------------------
▶ 참고: 제13장 용액의 성질. 목차
[ https://ywpop.tistory.com/15289 ]
---------------------------------------------------
▶ 참고: 총괄성 [ https://ywpop.tistory.com/2648 ]
1. 증기압내림
2. 끓는점오름
3. 어는점내림
4. 삼투압
4개 성질 모두 용해된 용질 입자의 개수(농도)에 비례.
용질이 전해질이면, 이온화된(해리된) 이온의 개수에 비례.
만약 같은 농도의 설탕물과 소금물이 있다면,
( 예를 들면, 1 m 설탕 수용액과 1 m 소금 수용액 )
C12H22O11(s) + H2O(l) → C12H22O11(aq) ... 1개 입자 (i = 1)
NaCl(s) + H2O(l) → Na^+(aq) + Cl^-(aq) ... 2개 입자 (i = 2)
이므로, 소금물의 총괄성이 설탕물보다 더 크다(높다),
즉 설탕 용액보다
소금 용액의 증기압이 더 내려가고, 끓는점이 더 올라가고,
어는점이 더 내려가고, 삼투압이 더 높다.
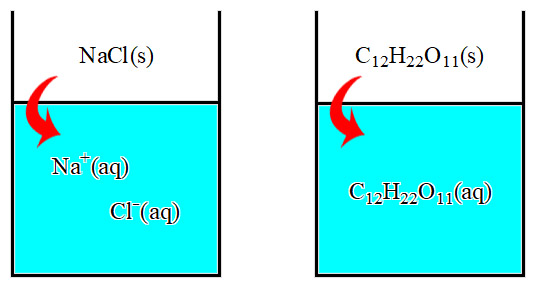
[그림] 소금물(전해질 용액)과 설탕물(비전해질 용액)의 차이.
만약 같은 농도의 NaCl 용액과 MgCl2 용액이 있다면,
( 예를 들면, 1 m NaCl 수용액과 1 m MgCl2 수용액 )
NaCl(aq) → Na^+(aq) + Cl^-(aq) ... 전체 이온의 개수 = 2 (i = 2)
MgCl2(aq) → Mg^2+(aq) + 2Cl^-(aq) ... 전체 이온의 개수 = 3 (i = 3)
이므로, MgCl2 용액의 총괄성이 NaCl 용액보다 더 크다(높다),
즉 NaCl 용액보다
MgCl2 용액의 증기압이 더 내려가고, 끓는점이 더 올라가고,
어는점이 더 내려가고, 삼투압이 더 높다.
[ 관련 예제 https://ywpop.tistory.com/22382 ] 염화마그네슘 0.952 g을 물 100 g에 녹인 용액의 삼투압
[키워드] 설탕물과 소금물 기준문서, 소금물과 설탕물 기준문서, 설탕과 소금 기준문서, 소금과 설탕 기준문서
'일반화학 > [13장] 용액의 성질' 카테고리의 다른 글
| 삼투압과 분자량. 15.0 mg met-enkephalin의 몰질량 (0) | 2016.11.24 |
|---|---|
| Fe(NH4)2(SO4)2의 반트호프 인자 이론값(예상값) (0) | 2016.11.14 |
| 물의 증기압 23.76 mmHg 바닷물의 증기압 22.98 mmHg NaCl 몰랄농도 (0) | 2016.10.01 |
| 전해질의 증기압내림. CaCl2 수용액의 증기압 (0) | 2016.09.27 |
| 총괄성. 삼투압과 헤모글로빈의 몰질량 (1) | 2016.04.14 |
| 끓는점오름보다 어는점내림을 더 많이 사용하는 이유 (0) | 2015.10.12 |
| van’t Hoff LiCl 0.62 m 1.96 vapor water 298 K 23.76 mmHg (0) | 2015.09.29 |
| 총괄성. 글루코스 용액의 끓는점과 어는점 (0) | 2015.09.21 |
댓글