CH4 연소반응. CH4 산화-환원 반응
CH4는 CO2로 산화되었다 하는데,
왜 H2O로 산화가 아닌가요?
---------------------------------------------------
▶ 참고: 산화-환원과 산화수
[ https://ywpop.tistory.com/6525 ]
---------------------------------------------------
가령 CH4가 H2O로 산화되었다 치면,
이 과정에서 산화수가 변한 원자가 있어야 하는데,
양쪽에 공통으로 존재하는 H 원자의 산화수는
+1로 변화가 없습니다.
---> 따라서 이렇게 산화되지는 않습니다.
( CH4와 H2O에서 H의 산화수는 +1로 같다. )
( 참고: CH4와 H2O의 산화수 https://ywpop.tistory.com/8810 )
▶ CH4를 구성하는 원자는 ① C와 ② H
① 생성물에서 C를 포함하는 분자는 CO2
CH4 → CO2 에서,
C의 산화수는 –4에서 +4로 증가.
---> 이렇게 산화됨.
② 생성물에서 H를 포함하는 분자는 H2O
CH4 → H2O 에서,
H의 산화수는 +1에서 +1로 변화 없음.
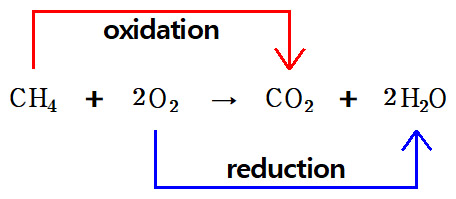
메탄 연소 반응식
CH4 + 2O2 → CO2 + 2H2O
▶ 산화 반쪽반응: CH4 → CO2
> C의 산화수는 –4에서 +4로 증가.
> CH4는 CO2로 산화됨. CH4는 환원제.
▶ 환원 반쪽반응: O2 → H2O
> O의 산화수는 0에서 –2로 감소.
> O2는 H2O로 환원됨. O2는 산화제.
※ 산소의 이동으로 설명
( 각 반쪽 반응식의 합은 전체 반응식과 같아야 한다. )
> CH4 → CO2
---> 산소의 개수 증가, CH4는 산화되었다.
> 2O2 → 2H2O
---> 산소의 개수 감소, O2는 환원되었다.
※ 수소의 이동으로 설명
( 각 반쪽 반응식의 합은 전체 반응식과 같아야 한다. )
> CH4 → CO2
---> 수소의 개수 감소, CH4는 산화되었다.
> 2O2 → 2H2O
---> 수소의 개수 증가, O2는 환원되었다.
메탄의 연소반응에서
산화된 물질은 CH4, 환원된 물질은 O2.
산화-환원반응에서, 산화제/환원제는
즉 산화된 물질/환원된 물질은
반드시 반응물에서 찾아야 된다.
( 참고 https://ywpop.tistory.com/8035 )
[ 관련 글 https://ywpop.blogspot.com/2024/08/ch4-2o2-co2-2h2o.html ]
산화-환원 연결. CH4 + 2O2 → CO2 + 2H2O
[ 관련 글 https://ywpop.tistory.com/2719 ] 산화수 구하는 규칙(rule)
[ 관련 글 https://ywpop.tistory.com/9588 ] redox balance. CH4 + O2 → CO2 + H2O
[키워드] redox CH4 + O2, redox O2 + CH4, redox CH4 + 2O2 → CO2 + 2H2O
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 산화-환원 반응의 이해. Cu + 2Ag^+ → 2Ag + Cu^2+ (0) | 2015.11.29 |
|---|---|
| 산화-환원 반응. MnO2 + 4HCl → MnCl2 + 2H2O + Cl2 (2) | 2015.11.28 |
| 산화-환원 반응. redox Fe + AgNO3 (0) | 2015.11.27 |
| 강산(strong acid)의 종류와 세기 (0) | 2015.11.17 |
| Cr^3+ + H2O2 → Cr2O7^2- + 2H2O 반응에서 산화제와 환원제 (0) | 2015.10.20 |
| 산-염기 중화반응 결과 생성되는 염은 강전해질? 약전해질? (0) | 2015.10.04 |
| 강산 (Strong Acids) 강염기 (Strong Bases) (0) | 2015.09.29 |
| 산-염기 반응식 완성하기. 2HCl + Ca(OH)2 (0) | 2015.09.23 |

댓글