산화제와 환원제. redox CH4 + H2O → CO + 3H2
---------------------------------------------------
▶ 참고: 산화수 구하는 규칙(rule)
[ https://ywpop.tistory.com/2719 ]
---------------------------------------------------
CH4 에서,
H의 산화수 = +1 (넘버 2) 이므로,
(C) + 4(H) = 0
(C) + 4(+1) = 0
---> C의 산화수 = –4.
[참고] 전기음성도 차이로 계산
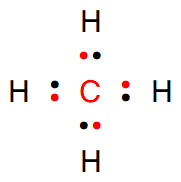
> C의 전기음성도 = 2.55
> H의 전기음성도 = 2.20
전기음성도가 더 큰 C가 공유전자쌍을 독차지하므로,
> C의 산화수 = –4
> H의 산화수 = +1
( 참고 https://ywpop.tistory.com/7863 )
H2O 에서,
H의 산화수 = +1 (넘버 2) 이므로,
2(H) + (O) = 0
2(+1) + (O) = 0
---> O의 산화수 = –2.
CO 에서,
O의 산화수 = –2 (넘버 3) 이므로,
(C) + (O) = 0
(C) + (–2) = 0
---> C의 산화수 = +2.
( 참고: CO2의 산화수 https://ywpop.tistory.com/9621 )
H2 에서,
H의 산화수 = 0.
( 원소의 산화수 = 0 )
CH4 → CO (C의 산화수는 –4에서 +2로 증가)
---> CH4는 CO로 산화됨.
---> CH4는 환원제.
H2O → H2 (H의 산화수는 +1에서 0으로 감소)
---> H2O는 H2로 환원됨.
---> H2O는 산화제.
> C is oxidized by H2O, therefore H2O is the oxidizing agent.
> H is reduced by CH4, therefore CH4 is the reducing agent.
---------------------------------------------------
[참고] CH4에도 H가 있는데, CH4를 산화제라고 볼 수는 없나요?
▶ 산화제의 정의: 다른 물질을 산화시키는 물질
▶ 환원제의 정의: 다른 물질을 환원시키는 물질
( 참고 https://ywpop.tistory.com/8035 )
에서와 같이, “일반적으로” 산화-환원 반응에서
“산화제와 환원제는 서로 다른 물질”입니다.
redox Cl2 + H2O → HClO + HCl 반응과 같이,
( 참고 https://ywpop.tistory.com/7928 )
한 물질(Cl2)이 동시에 산화도 되고, 환원도 되는
불균등화 반응도 있지만,
이때 다른 물질(H2O)의 산화수는 변하지 않아야 됩니다.
CH4 + H2O → CO + 3H2 반응에서는
CH4의 산화수도 변했고, H2O의 산화수도 변했기 때문에,
반드시 어느 하나는 산화제, 다른 하나는 환원제가 되어야 합니다.
[ 관련 글 https://ywpop.tistory.com/470795 ]
redox CO + H2O → CO2 + H2
[키워드] CH4의 산화수 기준, H2O의 산화수, CO의 산화수, CH4 루이스 구조 기준, CH4 루이스 기준
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 수산화바륨과 염화암모늄의 반응. Ba(OH)2 + NH4Cl (2) | 2018.05.08 |
|---|---|
| FeS의 산화수 (0) | 2018.05.03 |
| 용해도 지침 이용 방법. 용해도 지침 사용 방법 (0) | 2018.04.28 |
| 알짜이온반응식. Zn + H2SO4 → ZnSO4 + H2 (0) | 2018.04.23 |
| 물 1 L에 NaOH를 0.4 g 녹인 용액의 pH ★ (0) | 2018.03.31 |
| IO3^-의 산화수. I3^-의 산화수 (0) | 2018.03.14 |
| S4O6^2-의 산화수. tetrathionate anion의 산화수 (2) | 2018.02.19 |
| PbSO4의 산화수 (0) | 2018.02.18 |


댓글