격자 에너지. Lattice Energy. NaCl
---------------------------------------------------
▶ 참고: 제8장 화학 결합의 기본 개념. 목차
[ https://ywpop.tistory.com/15249 ]
---------------------------------------------------
▶ 격자 에너지, 격자 엔탈피
> 고체 상태의 이온 결합 화합물을 기체 상태의 이온으로 만드는데 필요한 에너지
( 필요한 에너지이므로, 격자 엔탈피의 값은 항상 양(+)의 값. )
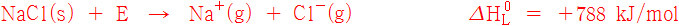
▶ 격자 에너지는 이온 결합 화합물의 안정성 척도
> 격자 에너지 값이 클수록, 안정한 이온 결합 화합물.
( 참고: 결합 에너지 https://ywpop.tistory.com/7168 )
▶ 일반적으로 물질이 안정할수록, 그 물질의 녹는점은 높다.
> 격자 에너지 값이 클수록, 이온 결합 화합물의 녹는점은 높다.
( 참고 https://ywpop.tistory.com/8268 )
▶ 격자 에너지는 쿨롱 힘에 비례하고,
쿨롱 힘은 두 전하의 곱에 비례, 거리에 반비례.
▶ 쿨롱 법칙(Coulomb's law) 또는 쿨롱 힘 법칙(Coulomb force law)
F = ke [(q1 × q2) / r^2]

▶ 격자 에너지는 직접 측정할 수 없다.
> Hess 법칙에 기초한, Born-Haber 순환(cycle)을 이용하여 간접적으로 계산.
---> 즉, 이론적(수학적)으로 계산할 수 있다.
▶ 이온 결합 화합물의 격자 에너지 계산 과정
( 이 순서만 암기하면, 격자 에너지 관련 계산 문제는 아무것도 아니다. 너무나 쉽다. )
.. 1. 금속 성분의 승화 엔탈피, sublimation enthalpy ... ΔH = + kJ/mol
.. 2. 금속 성분의 이온화 에너지, ionization energy ... ΔH = + kJ/mol
.. 3. 비금속 성분의 결합 해리 엔탈피, bond dissociation enthalpy ... ΔH = + kJ/mol
.. 4. 비금속 성분의 전자 친화도, electron affinity ... ΔH = – kJ/mol
+) 5. 격자 에너지의 역과정, –lattice energy ... ΔH = ? kJ/mol
---------------------------------------------------------------------------------
.. (합) 표준 생성 엔탈피, standard enthalpy of formation ... ΔH = ? kJ/mol
▶ 단, 이때 표준 생성 엔탈피의 정의를 알고 있어야 하며,
( 참고: 표준 생성 엔탈피 https://ywpop.tistory.com/4416 )
주어진 화합물로부터 생성 반응식을 작성할 줄 알아야 한다.
즉, 문제에서 생성 반응식을 주지 않고,
NaCl의 격자 에너지를 구하시오. 또는
NaCl의 생성 엔탈피를 구하시오. 라고 요구하면,
표준 생성 엔탈피의 정의로부터,
Na(s) + 1/2 Cl2(g) → NaCl(s)
와 같이 생성 반응식을 작성할 줄 알아야 된다.
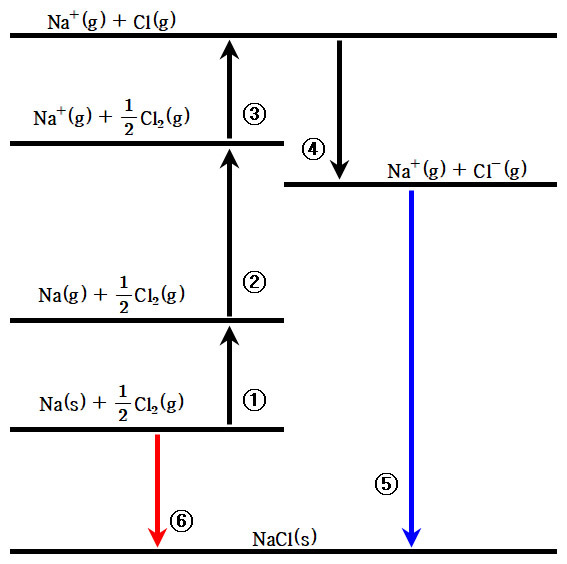

※ 주의: 1/2 Cl2(g) → Cl(g) 의 ΔH = +242 / 2 = +121 kJ/mol
즉, Cl2(g)의 결합 해리 엔탈피 = +242 kJ/mol 의 1/2 임에 주의할 것.
[참고] ⑤번, ⑥번 과정과 같이,
에너지 준위가 높은 상태에서
(보다 안정한) 에너지 준위가 낮은 상태로
물질의 상태가 바뀔 때는 (이동할 때는)
두 상태의 에너지 준위 차이만큼
에너지를 방출한다.
---> 이때 ΔH의 값은 음수(–), 즉 ΔH < 0.
[ 관련 예제 https://ywpop.tistory.com/3119 ] CaCl2의 격자 에너지
[ 관련 글 https://ywpop.tistory.com/6061 ] 격자 에너지(와 녹는점) 도표
[ 관련 글 https://ywpop.tistory.com/14780 ] 격자 에너지 도표
[ 관련 예제 https://ywpop.tistory.com/11721 ] 이온결합 세기. MgBr2 MgO NaBr CaO
[ 관련 예제 https://ywpop.tistory.com/search/격자에너지%20계산%20기준문서 ]
[키워드] NaCl의 격자 에너지 기준문서, 격자 에너지 계산 기준문서, 일반화학 08장 화학 결합의 기본 개념-1, NaCl의 격자 에너지 사전, 격자 에너지 계산 사전
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| IO3^- 루이스 구조 그리기. iodate ion (0) | 2015.07.13 |
|---|---|
| 확장 팔전자 규칙 또는 18 전자 규칙 ★ (0) | 2015.07.12 |
| 이온 결합 화합물과 분자 화합물 구별 (3) | 2015.04.13 |
| 격자 에너지. Lattice Energy. CaCl2 ★ (1) | 2015.01.05 |
| 3가지 화학 결합 ★ (1) | 2014.11.29 |
| NH4^+는 극성 분자인가? 쌍극자모멘트 값은? (1) | 2014.11.04 |
| 루이스 전자 점 기호로 나타낸 주기율표 (1) | 2014.10.13 |
| 공명 구조. resonance structures ★ (0) | 2014.06.26 |



댓글