분자가 아닌 이유
화학식대로 독립적으로 단독으로 존재하나? 안하나?
---------------------------------------------------
▶ 참고: 원자와 분자, 원소와 화합물
[ https://ywpop.tistory.com/2984 ]
▶ 참고: 분자성 화합물과 이온성 화합물의 구별
[ https://ywpop.tistory.com/8857 ]
---------------------------------------------------
분자가 되기 위해서는 (분자라고 부를 수 있기 위해서는)
원소나 화합물이 (화학식과 같은 결합 형태로)
한 개씩 독립하여 (서로 떨어져서) 존재할 수 있나? 없나? 로 구분합니다.
독립하여 존재할 수 있는 원소는 분자라고도 부를 수 있으나,
독립하여 존재할 수 없는 원소는 오로지 원소라고만 부릅니다.
상온, 상압 하에서, 그러니까 일반적인 조건하에서,
헬륨(He), 산소 분자(O2), 질소 분자(N2) 등은
원소 하나하나가 따로 떨어져서 존재합니다.
( 따라서 분자라고 부를 수 있습니다. )

[그림] Atmosphere를 구성하는 분자.
nitrogen, oxygen, carbon dioxide, water molecules.
그러나 철(Fe)과 같은 금속, 다이아몬드(C), 흑연(C) 등은
원소 하나하나가 따로 떨어져서 존재하지 않습니다.
물질을 구성하는 원소들이 상하 좌우 앞뒤로 쭉 연결되어 있는데,
이런 물질들이 갖는 구조를
3차원 격자 구조 또는 결정 구조(crystal structure)라 합니다.
( 이런 물질들은 분자라 부를 수 없고, 오로지 원소라고만 부릅니다. )
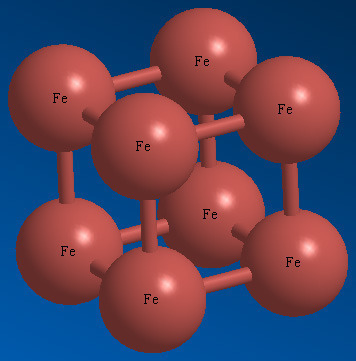
[그림] Iron metal crystal structure.
위와 같은 기본 구조가 3차원적으로 확장된 것이 금속 철의 결정 구조이다.

[ 그림 출처 wikimedia ] Diamond structure.
파란 공 1개 = 탄소 원자 1개.
같은 이유로, NaCl, Cu2O과 같은 이온결합성 화합물도
분자라 부를 수 없고, 오로지 화합물이라고만 부릅니다.
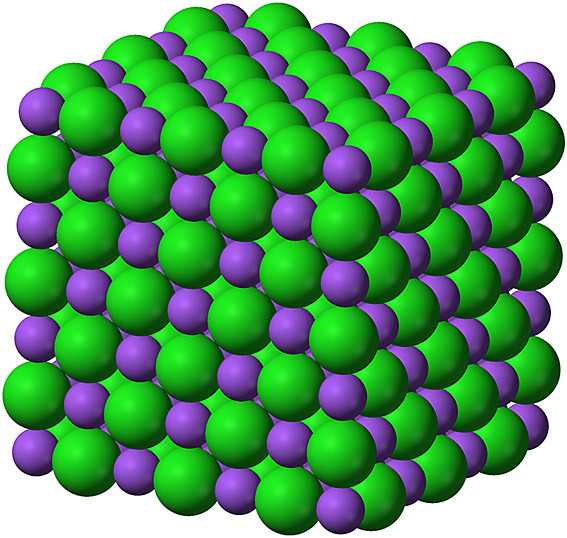
[그림] Crystal structure of NaCl.
나트륨 이온(자주색)과 염화 이온(녹색).
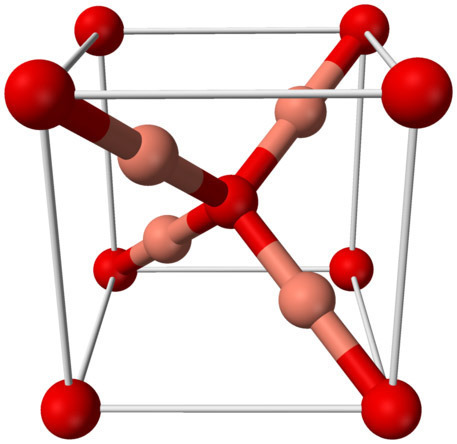
[그림] Crystal structure of Cu2O, copper(I) oxide.
빨강색=산소(O), 살색(연분홍색)=구리(Cu).
[ 관련 글 https://ywpop.tistory.com/5085 ] 고체의 구조와 결정 격자
철(Fe)과 같은 금속, 다이아몬드(C), 흑연(C) 등은 원자 격자.
[ 관련 글 http://ywpop.tistory.com/8942 ] 공유결합 물질의 끓는점 차이
[참고] 화학 반응식에서 철(Fe)은 “원소”
예를 들어, 다음과 같은 화학 반응식에서,
4Fe(s) + 3O2(g) → 2Fe2O3(s)
Fe는 원자가 아니라 “원소”를 나타낸 것입니다.
※ 참고로, 홑원소물질은 더 이상 사용하지 않는 용어입니다.
( 단, 대한민국 중고등학교 교재는 예외. )
홑원소물질에 해당하는 물질은 전부 원소에 해당합니다.
※ 만약 3가지 종류의 화학결합에 대해 잘 알고 있다면,
( 참고: 3가지 화학결합 https://ywpop.tistory.com/3036 )
이온결합(예: NaCl, Al2O3) 또는
금속결합(예: Fe, Cu)이면, 100% 분자가 아닙니다.
이온결합이면, 100% 화합물이고,
금속결합이면, 100% 원소입니다.
( 참고: 금속간 화합물 https://ywpop.tistory.com/4744 )
공유결합(예: H2, O2, H2O)만 분자인데,
단, 그물망(network) 형태의 공유결합(예, 다이아몬드, 흑연)은
분자가 아닙니다. 이들은 원소입니다.
( 참고: 그물구조 공유결합 https://ywpop.tistory.com/8942 )
[ 관련 예제 https://ywpop.tistory.com/6781 ] 분자 고르기.
CH4, NaBr, BaF2, CCl4, ICl, CsCl, NF3
[키워드] 이온결합 화합물과 분자화합물 기준문서, 이온결합과 공유결합 기준문서, 공유결합과 이온결합 기준문서, 분자 기준문서, 분자성 화합물 기준문서, 분자와 이온결합 화합물 기준문서, 분자가 아닌 기준문서, 분자가 아닌 사전, 분자라 부를 수 기준문서, 분자라고 부를 수 기준문서, 원자와 분자 기준문서, 원소와 화합물 기준문서, 분자와 화합물 기준문서, 원자와 분자 사전, 원소와 화합물 사전, 분자와 화합물 사전
---------------------------------------------------
모든 기체는 분자 상태로 존재한다.
이온 결합 화합물인 NaCl도 기체가 되면 분자 상태로 존재한다.
▶ In the gas phase sodium chloride exists as a monomer
(the sodium chloride molecule) along with its dimer Na2Cl2.
[ 참고 https://chemistry.stackexchange.com/questions/14174/what-is-sodium-chloride-like-in-gas-state ]
▶ In the gas phase (and ionic compounds tend to have extremely low volatilities and extremely high boiling points), ions are associated into “molecules” or “clusters” of a few ions, in such a way that charges are balanced.
[ 참고 https://www.quora.com/What-happens-to-NaCl-ions-in-molten-and-gaseous-states ]
▶ In the gas phase, you can have a NaCl molecule.
[ 참고 https://www.quora.com/Can-NaCl-be-described-as-a-molecule ]
▶ Can NaCl be described as a molecule?
In the gas phase, you can have a NaCl molecule (although the bonding is still mostly ionic).
[ 참고 https://www.quora.com/Can-NaCl-be-described-as-a-molecule ]
▶ A molecule is the smallest particle in a chemical element or compound that has the chemical properties of that element or compound. Molecules are made up of atoms that are held together by chemical bonds. These bonds form as a result of the sharing or exchange of electrons among atoms.
[ 참고 https://www.quora.com/What-is-a-molecule ]
[키워드] 철은 원소 기준, NaCl도 분자, NaCl 분자 기준, 분자가 아닌 이유 기준, 분자가 아닌 이유 사전
'화학' 카테고리의 다른 글
| 0.10 M (C2H5)3N 용액의 pH (0) | 2019.02.26 |
|---|---|
| RbCl의 격자에너지 (0) | 2019.02.25 |
| 온도환산. 섭씨를 화씨로. 20℃를 ℉로 (0) | 2019.02.25 |
| 앙금 생성 여부. Ca(NO3)2 + NaCl (0) | 2019.02.25 |
| (가) 5% 설탕 수용액 500 g과 (나) 5% 포도당 수용액 500 g (0) | 2019.02.23 |
| 0.1 M A 수용액을 묽혀 x M A 수용액 만들기 (0) | 2019.02.23 |
| 4% 용액으로 200 ppm 용액 100 L 만들기 (0) | 2019.02.23 |
| 탄산수소칼륨 용액 만들기. KHCO3 용액 만들기 (0) | 2019.02.23 |
댓글