전기화학 전지. electrochemical cell
---------------------------------------------------
▶ 참고: 제20장 전기화학. 목차
[ https://ywpop.tistory.com/11389 ]
---------------------------------------------------
▶ 전지의 기본 구성
① 전해질 용액 (& 용기)
② 전극: 금속 또는 탄소봉(흑연)
> 池: 못 지
> 전지 = 전해질 연못
▶ 산화-환원 반응을 이용하여, 화학 에너지를 전기 에너지로, 또는
전기 에너지를 화학 에너지로 변환시키는 장치를 ‘전기화학 전지’라 한다.
▶ 크게 (1) 볼타 전지와 (2) 전해 전지로 분류한다.
( 또는 갈바니 전지와 전해 전지로 분류하기도 한다. )
( galvanic cell vs. electrolytic cell )
[1] 볼타(Volta) 전지
▶ 화학 에너지를 전기 에너지로 변환시키는 장치. 일반적으로 ‘전지’라 부른다.
▶ “자발적인 산화-환원 반응”에 의해 전기가 발생하는 전지를 통칭
( 볼타 전지, 다니엘 전지, 건전지, 수은 전지, 축전지 등
자발적인 산화-환원 반응에 의해 전기가 발생하는 전지는
모두 볼타 전지에 속한다. )
▶ 볼타 전지의 발명은 ‘전기화학’이라는 새로운 학문 분야를 탄생시켰다.
※ 갈바니(Galvani): 동물전기 발견
[2] 전해 전지. electrolytic cell
▶ 전기 에너지를 화학 에너지로 변환시키는 장치. ‘전기분해장치’라고도 한다.
▶ 외부 전기에 의해 “비자발적인 산화-환원 반응”이 일어나는 전지를 통칭
( 외부에서 전기를 공급하여 비자발적인 산화-환원 반응이 일어나도록 만든 전지 )
---------------------------------------------------
(1) 볼타 전지의 반응과 특징
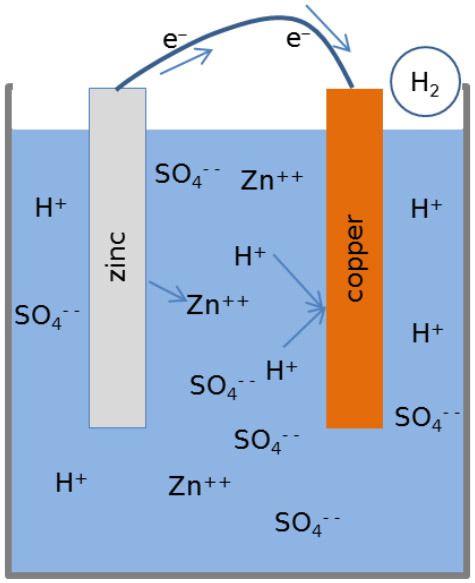
▶ 묽은(20%) 황산 수용액이 들어있는 1개의 용기에
아연 전극과 구리 전극을 함께 넣고, 두 전극을 전선으로 연결.
[ 그림 출처 Wikipedia ]
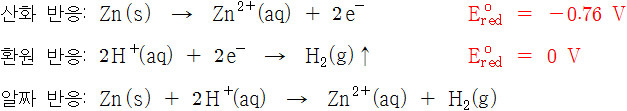
▶ 볼타 전지의 기전력: 0.76 V

▶ 분극 현상 때문에 금방 전압이 떨어진다.
⇨ 비실용적
▶ 분극 현상: 구리 전극 주변에 생성된 수소 기체의 이탈 속도가
전자의 이동 속도보다 느려서
수소 기체가 구리 전극 주변을 둘러싸 전자의 이동을 방해.
2H^+(aq) + 2e^- → H2(g)↑
생성된 수소 기체가 H^+(aq)와 e^-의 반응을 방해
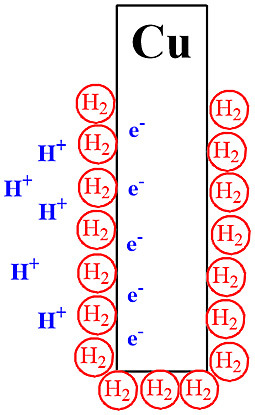
[그림] 분극 현상.
▶ 이산화망간(MnO2) 등과 같은 산화제를 구리 전극 주변에 넣어 주면,
수소 기체가 물로 변하여 ‘분극 현상’이 없어지므로 전류가 잘 흐르게 된다.
이때 쓰인 산화제를 ‘감극제(소극제)’라고 한다.
(2) 다니엘(Daniel) 전지의 반응과 특징
▶ 볼타 전지의 문제점(분극 현상)을 해결한 전지
▶ 전지 2개와 염다리(salt bridge)를 사용, 분극 현상 해결.
▶ 묽은 황산아연 수용액이 들어있는 용기에 아연 전극을 넣고,
묽은 황산구리 수용액이 들어있는 용기에 구리 전극을 넣고,
두 전극을 전선으로 연결.
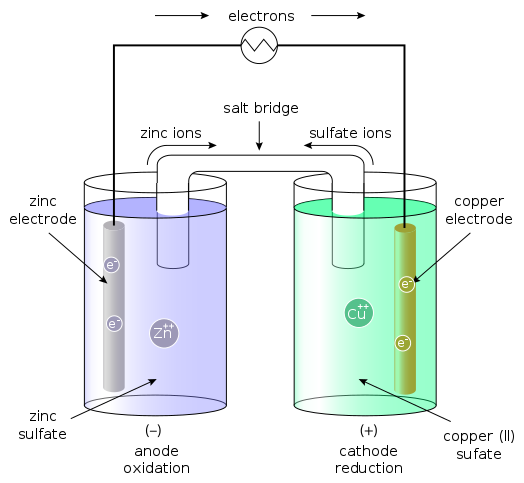
[ 그림 출처 Wikimedia ] 전자(e^-)는 전선을 통해 아연(Zn) 전극에서 구리(Cu) 전극으로 이동한다.

> 산화: Zn(s) → Zn^2+(aq) + 2e^- ... E°_red = –0.76 V
> 환원: Cu^2+(aq) + 2e^- → Cu(s) ... E°_red = +0.34 V
> 전체: Zn(s) + Cu^2+(aq) → Zn^2+(aq) + Cu(s)
▶ cell diagram
Zn | Zn^2+ || Cu^2+ | Cu 또는
Zn(s) | Zn^2+(aq) || Cu^2+(aq) | Cu(s)
( 참고 https://ywpop.tistory.com/3072 )
▶ 다니엘 전지의 기전력: 1.10 V
( 참고 https://ywpop.tistory.com/4558 )

※ 외형적으로, 볼타 전지는 전지가 1개이고, 다니엘 전지는 전지가 2개이다.
[ 관련 글 https://ywpop.tistory.com/8254 ] 전기화학 전지 용어 정의
[ 관련 글 https://ywpop.tistory.com/4282 ] 납 축전지
[ 관련 글 https://ywpop.tistory.com/4499 ] 수소 연료 전지
[ 관련 글 https://ywpop.tistory.com/4282 ] 리튬 이온 전지
[키워드] 전기화학 전지 기준문서, 볼타 전지 기준문서, 다니엘 전지 기준문서, 전기화학 전지 사전, 볼타 전지 사전, 다니엘 전지 사전, 분극 현상 사전, 감극제 사전
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 볼타 전지 간단 표기법. cell diagram. cell notation (1) | 2014.12.11 |
|---|---|
| 불균등화 반응. H2O2 산화-환원 반응 (0) | 2014.12.07 |
| redox balance. Br2 → BrO3^- + Br^- (acidic) (0) | 2014.11.26 |
| 비금속과 비금속의 산화-환원 반응 (0) | 2014.11.16 |
| 전기도금. electroplating. Cr^3+ 7.60 A 2.00 day (1) | 2014.11.12 |
| Nernst 식. 비표준 상태에서의 전지 전위 계산 ★ (0) | 2014.10.20 |
| 철의 부식, 철이 녹스는 것, 철의 산화 ★ (0) | 2014.10.20 |
| redox balance. Sn^2+ + NO3^- → Sn^4+ + NO (acidic) (0) | 2014.10.10 |




댓글