redox balance. Sn^2+ + NO3^- → Sn^4+ + NO (acidic)
redox NO3^- + Sn^2+ → NO + Sn^4+
---------------------------------------------------
▶ 참고: 산화-환원 반응 균형 맞추기 (산성 용액)
[ https://ywpop.tistory.com/4264 ]
---------------------------------------------------
전체 이온 반응식을 적는다.
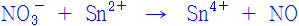
NO3^- + Sn^2+ → Sn^4+ + NO
[1단계] 반쪽 반응으로 나눈다.

산화: Sn^2+ → Sn^4+ (Sn의 산화수는 +2에서 +4로 증가, Sn^2+는 산화됨.)
환원: NO3^- → NO (N의 산화수는 +5에서 +2로 감소, NO3^-는 환원됨.)
> Sn2+ is a reducing agent.
> NO3^- is an oxidizing agent.
[2단계] 질량 균형 맞추기
각 반쪽 반응의 원자수를 맞춘다.
※순서: ① 다른 원자, ② 산소 원자(H2O로), ③ 수소 원자(H^+로)
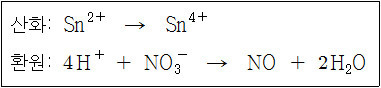
산화: Sn^2+ → Sn^4+
환원: NO3^- + 4H^+ → NO + 2H2O
[3단계] 전자(e^-)를 더해서, 전하 균형 맞추기
각 반쪽 반응의 전하량(하전 수)이 같도록 전자를 더한다.

산화: Sn^2+ → Sn^4+ + 2e^-
환원: NO3^- + 4H^+ + 3e^- → NO + 2H2O
[4단계] 주고받은(이동한) 전자 수 같도록
두 반쪽 반응의 전자의 몰수를 같게 한다.
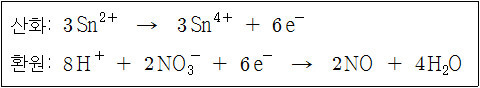
산화: Sn^2+ → Sn^4+ + 2e^- (×3)
환원: NO3^- + 4H^+ + 3e^- → NO + 2H2O (×2)
산화: 3Sn^2+ → 3Sn^4+ + 6e^-
환원: 2NO3^- + 8H^+ + 6e^- → 2NO + 4H2O
[마지막 단계] 두 반쪽 반응을 더한다. 끝.

3Sn^2+ + 2NO3^- + 8H^+ → 3Sn^4+ + 2NO + 4H2O
[키워드] redox Sn^2+ + NO3^-, redox NO3^- + Sn^2+
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 볼타 전지 간단 표기법. cell diagram. cell notation (1) | 2014.12.11 |
|---|---|
| 불균등화 반응. H2O2 산화-환원 반응 (0) | 2014.12.07 |
| redox balance. Br2 → BrO3^- + Br^- (acidic) (0) | 2014.11.26 |
| 비금속과 비금속의 산화-환원 반응 (0) | 2014.11.16 |
| 전기도금. electroplating. Cr^3+ 7.60 A 2.00 day (1) | 2014.11.12 |
| Nernst 식. 비표준 상태에서의 전지 전위 계산 ★ (0) | 2014.10.20 |
| 철의 부식, 철이 녹스는 것, 철의 산화 ★ (0) | 2014.10.20 |
| 전기화학 전지 (electrochemical cell) ★ (2) | 2014.09.23 |




댓글