불균등화 반응. H2O2 산화-환원 반응
과산화수소(H2O2)의 촉매 분해 반응
불균등화 반응(disproportionation): 과산화수소(H2O2) 산화-환원 반응
Disproportionation: hydrogen peroxide(H2O2) redox equation
---------------------------------------------------
▶ 참고: 산화-환원 반응 균형 맞추기 (산성 용액)
[ https://ywpop.tistory.com/4264 ]
---------------------------------------------------
과산화수소는 동시에 산화되고, 환원된다.
H2O2 is simultaneously oxidised and reduced.
과산화수소처럼, 한 물질이 동시에 산화되고 환원되어
각각 다른 생성물을 만드는 반응을
불균등화 반응(disproportionation)이라고 한다.
( 참고 https://ywpop.tistory.com/2970 )
[산화 반쪽반응, oxidation half-reaction]
H2O2 → O2
> H2O2에서 O의 산화수 = –1
> O2에서 O의 산화수 = 0
---> O의 산화수는 –1에서 0으로 증가, H2O2는 산화됨.
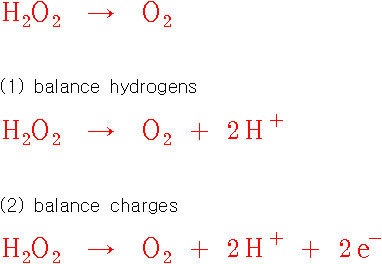
[환원 반쪽반응, reduction half-reaction]
H2O2 → H2O
> H2O2에서 O의 산화수 = –1
> H2O에서 O의 산화수 = –2
---> O의 산화수는 –1에서 –2로 감소, H2O2는 환원됨.

[전체 반응식]
두 반쪽반응식을 더하여, 전체 반응식을 완성한다.
이때 양성자와 전자는 소거된다.
Now you can add the two equations.
2H^+ and 2e^- cancel out from either side, so you are left with:
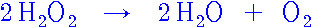
산화: H2O2 → O2 + 2H^+ + 2e^-
환원: H2O2 + 2H^+ + 2e^- → 2H2O
---------------------------------------------
전체: 2H2O2 → 2H2O + O2
2H2O2(aq) → 2H2O(l) + O2(g)
---------------------------------------------------
[참고] 과산화수소는 불안정하기 때문에,
보관하면, 천천히 물과 산소로 분해된다.
---> 빛이 과산화수소의 분해를 도와주므로,
빛이 없는 어두운 장소에 보관하면, 덜 분해된다.
Hydrogen peroxide is unstable and slowly decomposes in the presence of light. Because of its instability, hydrogen peroxide is typically stored with a stabilizer in a weakly acidic solution.
---------------------------------------------------
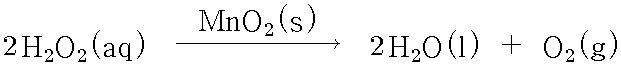
과산화수소는 가만히 놔두면 매우 느린 속도로 물과 산소로 분해된다.
Hydrogen peroxide, H2O2, decomposes naturally at a very slow rate to form water and oxygen gas.
2H2O2(aq) → 2H2O(l) + O2(g) ... slow rate
과산화수소 용액에 이산화망간을 첨가하면,
이산화망간이 촉매 역할을 해서 과산화수소의 분해 속도는 크게 증가한다.
When manganese dioxide, MnO2, is added to a solution of hydrogen peroxide, the rate of the reaction increases significantly. Manganese dioxide acts as a catalyst for the decomposition of hydrogen peroxide, meaning that it is not consumed in the reaction.
2H2O2(aq) + MnO2(s) → 2H2O(l) + O2(g) + MnO2(s) ... fast rate
[ 관련 글 https://ywpop.tistory.com/2971 ] H2O2의 촉매 분해 반응
[키워드] 과산화수소의 산화-환원 기준문서, H2O2의 산화-환원 기준문서, redox H2O2 dic, 과산화수소 분해 기준문서, H2O2 분해 기준문서, 과산화수소의 분해 기준문서, H2O2의 분해 기준문서, redox H2O2 → H2O + O2, redox H2O2 → O2 + H2O, redox 2H2O2 → O2 + 2H2O, MnO2 + H2O2, H2O2 + MnO2, 불균등화 반응 기준문서, 과산화수소의 산화-환원 사전, H2O2의 산화-환원 사전, 과산화수소 분해 사전, H2O2 분해 사전, 과산화수소의 분해 사전, H2O2의 분해 사전, H2O2 촉매 분해 기준문서, H2O2 촉매 분해 사전, 과산화수소 촉매 분해 기준문서, 과산화수소 촉매 분해 사전, H2O2 촉매 기준문서, H2O2 촉매 사전, 과산화수소 촉매 기준문서, 과산화수소 촉매 사전
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 다니엘 전지의 염다리, salt bridge (1) | 2015.05.26 |
|---|---|
| redox balance. MnO4^- + H2O2 + H^+ → Mn^2+ + O2 + H2O (0) | 2015.04.23 |
| 소금의 전기분해. Electrolysis of sodium chloride (NaCl) ★ (2) | 2014.12.11 |
| 볼타 전지 간단 표기법. cell diagram. cell notation (1) | 2014.12.11 |
| redox balance. Br2 → BrO3^- + Br^- (acidic) (0) | 2014.11.26 |
| 비금속과 비금속의 산화-환원 반응 (0) | 2014.11.16 |
| 전기도금. electroplating. Cr^3+ 7.60 A 2.00 day (1) | 2014.11.12 |
| Nernst 식. 비표준 상태에서의 전지 전위 계산 ★ (0) | 2014.10.20 |




댓글