평형상수의 온도의존성. 반트호프 식. van’t Hoff equation
---------------------------------------------------
▶ 참고: 제15장 화학 평형. 목차
[ https://ywpop.tistory.com/15313 ]
---------------------------------------------------
▶ 화학 반응의 평형 상수는 온도에 따라 달라진다.
▶ 반트호프 식
> 평형 상수와 온도 사이의 열역학적인 관계를 나타낸 식
---> 반응 엔탈피를 구할 수 있다.

[ 그림 출처 Wikimedia ] Portrait of Jacobus Henricus van’t Hoff.
야코뷔스 헨리퀴스 판트호프 (1852 ~ 1911). 네덜란드의 물리화학자, 유기화학자.
[반트호프 식의 유도]
ΔG° = ΔH° – TΔS° ... (1)
( 참고 https://ywpop.tistory.com/7438 )
ΔG° = –RT lnK ... (2)
( 참고 https://ywpop.tistory.com/4481 )
(2) = (1)
–RT lnK = ΔH° – TΔS°
lnK = (–ΔH° / RT) + (ΔS° / R)
온도 T_1에서, 평형 상수 K_1 이고,
온도 T_2에서, 평형 상수 K_2 일 때,
lnK_1 = (–ΔH° / RT_1) + (ΔS° / R) ... (3)
lnK_2 = (–ΔH° / RT_2) + (ΔS° / R) ... (4)
(4) – (3)
lnK_2 – lnK_1 = ln(K_2 / K_1) = (–ΔH° / R) (1/T_2 – 1/T_1)
ln(K_2 / K_1) = (ΔH° / R) (1/T_1 – 1/T_2)
( 참고 https://ywpop.tistory.com/13022 )
( R = 8.314 J/mol•K )
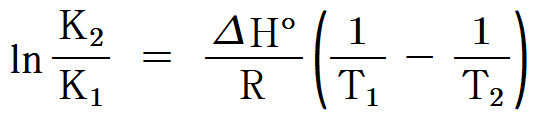
[ 관련 글 https://ywpop.tistory.com/24320 ] Van’t Hoff 방정식의 유도 (2)

[ 관련 예제 https://ywpop.tistory.com/10162 ] 어떤 반응의 평형상수는 온도가 300.0 K에서 350.0 K로 증가하면 2.84 비율만큼 증가한다. 이 반응에 대한 표준엔탈피 변화(ΔH°)를 계산하라.
[ 관련 예제 https://ywpop.tistory.com/12728 ] 물의 자동이온화상수 Kw는 298 K와 313 K에서 각각 1.008×10^(-14) 과 2.916×10^(-14) 이다. van’t Hoff 방정식에 근거하여 100℃ (373 K)에서 물의 pH를 구하시오.
[ 관련 글 https://ywpop.tistory.com/4560 ] 속도상수와 온도. 평형상수와 온도
[키워드] 판트 호프 방정식 기준문서, 판트 호프 식 기준문서, 반트 호프 방정식 기준문서, 반트 호프 식 기준문서, 평형 상수 기준문서, 평형 상수의 온도 의존성 기준문서, 반트 호프 기준문서, 판트 호프 방정식 사전, 판트 호프 식 사전, 반트 호프 방정식 사전, 반트 호프 식 사전, 평형 상수 사전, 평형 상수의 온도 의존성 사전, 반트 호프 사전, 평형 상수와 온도 기준문서, 평형 상수와 온도 사전
'일반화학 > [15장] 화학 평형' 카테고리의 다른 글
| A + B ⇌ 2C. 0.4 mol A와 0.7 mol B를 녹여 만든 1 L 용액 (0) | 2020.04.23 |
|---|---|
| 평형상수 계산. 1 L 용기 속에 0.3몰 H2O(g)와 0.5몰 CO(g) (0) | 2020.03.11 |
| 0.6기압의 CO와 1.2기압의 Cl2이 반응 (1) | 2020.03.11 |
| 약산의 Ka 값이 매우 작다는 의미 (0) | 2020.02.24 |
| 평형상수 값. CH3OH(g) ⇌ CO(g) + 2H2(g) (1) | 2020.02.12 |
| 2NO(g) + O2(g) ⇌ 2NO2(g). 430℃ 평형상수 1.5×10^5 (2) | 2019.10.27 |
| Kp와 Kc. N2(g) + 3H2(g) ⇌ 2NH3(g) (0) | 2019.10.26 |
| 평형상수식에서 고체나 물은 제외하는 이유 (1) | 2019.09.28 |
댓글