수소 원자의 선 스펙트럼. 4개의 선 스펙트럼
수소 원자의 전자는 1개인데 왜 수소 원자의 선 스펙트럼의 선은 4개인가요?
선 스펙트럼을 측정할 때,
즉, 방전관 속에는 수소 원자가 달랑 1개만 존재하지 않습니다.
수많은 수소 원자가 존재하므로, 전자 역시 수많이 존재합니다.
게다가 전자는 한 번만 들떴다가 떨어지고 끝나는 것이 아니라,
방전 전압이 걸리는 동안에는 들떴다 떨어졌다를 무한 반복합니다.
수많은 전자들이 수없이 들떴다가 떨어지기를 반복하기 때문에,
들뜰 때 올라가는 껍질(n)의 위치도 다양하고,
또한 떨어질 때 떨어지는 껍질(n)의 위치도 다양합니다.
[보충 설명]
수소 기체들은 가만히 있는게 아니라,
엄청 빠른 속도로 운동하고 있는데,
이때 각 수소의 속도가 조금씩 다르다.
( 참고 https://ywpop.tistory.com/23066 )
이 때문에 전자들마다 들뜨는 정도가 차이나고,
이 때문에 바닥상태로 되돌아올 때
각 전자가 방출하는 에너지가 차이나기 때문에,
파장이 다른 빛이 관찰되는 것이다.
이중에서 우리 눈에 관찰되는 4개의 선 스펙트럼은
n>=3에서 n=2로 떨어지는 전자가 방출하는 빛에 의한 것으로,
우리는 이것을 ‘발머계열’이라 합니다.
[ 관련 글 https://ywpop.tistory.com/7258 ]
실제 발머계열에 해당되는 전이(선 스펙트럼의 선)는 4개보다 많습니다.
n=3 → n=2
n=4 → n=2
n=5 → n=2
n=6 → n=2
여기까지가 빛의 파장이 ‘가시광선 영역’에 해당되기 때문에
우리 눈에 관찰이 됩니다.
n=7 → n=2
n=8 → n=2
n=9 → n=2
...
등의 전이도 일어나지만, 이 영역은 ‘자외선 영역’에 해당되기 때문에
우리 눈에 관찰되지 않을 뿐입니다.
( 참고: n=7 → n=2 전이 파장 https://ywpop.tistory.com/13779 )
---------------------------------------------------
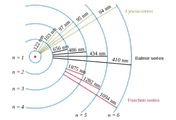
▶ 참고: 수소 스펙트럼 계열. hydrogen spectral series
[ https://ywpop.tistory.com/7437 ]
수소 원자의 전자 전이는 위 그림에 나오듯이 모든 계열에서 발생합니다.
현대의 분광기기로 측정하면, 모든 계열의 스펙트럼을 관찰할 수 있습니다.
atomic hydrogen emission spectrum
( 자료 http://www.chemguide.co.uk/atoms/properties/hspectrum.html )
학생들이 발머 계열만 발생한다고 착각할 수 있는 이유는
1) 초창기(옛날) 분광기기의 출력장치는 사진 필름(건판)이다.
2) 발머 계열만 사람 눈에 보이는 가시광선 영역이다.
3) 사진이 보여줄 수 있는 영역도 가시광선 영역(빨주노초파남보)이다.
( 위 검은색 바탕의 스펙트럼은 수소 원자가 방출하는 빛에 의해
노출된(노광된) 필름을 인화한 사진이라고 보면 됩니다. )
4) 교과서에는 옛날 초창기 스펙트럼만 보여준다,
이렇게 자세히 설명도 하지 않고...
---> 이 때문에 발머 계열만 발생한다고 착각할 수도 있습니다.
[ 관련 글 https://ywpop.tistory.com/12715 ] 수소 기체의 발머 계열 파장 계산. 1/λ = R (1/2^2 – 1/n^2)
[키워드] 발머 계열 기준, 수소 원자 스펙트럼 기준, 수소 원자 방출 스펙트럼 기준, 수소 원자 선 스펙트럼 기준, 수소 원자 스펙트럼 사전, 수소 원자 방출 스펙트럼 사전, 수소 원자 선 스펙트럼 사전
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 원자를 만든 조물주의 브리핑 (2) | 2017.10.02 |
|---|---|
| 3주기 원소와 18전자 (3) | 2017.09.27 |
| 원자의 바닥상태 전자배치. 바닥상태 원자의 전자배치 (0) | 2017.09.24 |
| 수소 스펙트럼 계열. hydrogen spectral series ★ (0) | 2017.07.01 |
| 전자 배치의 축약. 축약형 전자 배치 ★ (0) | 2017.06.06 |
| 선 스펙트럼이 발생하는 이유 (0) | 2017.06.04 |
| 은 금속의 일함수는 436 kJ/mol (0) | 2017.05.24 |
| 수소 원자에서 전자가 방출하는 에너지와 파장. n=1 to n=∞ ★ (0) | 2017.05.24 |

댓글