선 스펙트럼이 발생하는 이유
원자 방출 스펙트럼의 원리
1) 바닥상태(=안정한)에 있는 전자는 외부 에너지를 흡수하면,
들뜬상태(=불안정한)로 올라간다.
즉, 원자를 가열하거나 UV와 같은 강한 빛을 쏴주면,
바닥상태에 있는 전자는 들뜬다.
2) 들뜬 전자는 불안정하기 때문에,
( 들뜬 상태 = 불안정한 상태 )
( 사람도 높은 곳에 올라가면 불안해한다. )
( 관련 글 https://ywpop.tistory.com/5368 )
이내, 곧, 금방 다시 원래의 바닥상태로 되돌아온다, 내려온다.
3) 이때 전자는 외부에서 흡수한 에너지를 다시 외부로 버리면서,
즉, 외부로 에너지를 방출하면서 바닥상태로 되돌아온다.
( 전자가 불안정한 이유는 바로 외부 에너지를 흡수했기 때문이다. )
( 이 외부 에너지를 그대로 갖고 있어서는 다시 내려올 수 없다. )
( 그래서 흡수한 에너지를 버리고 내려오는 것이다. )
그리고 외부로 방출하는 에너지의 형태는 ‘빛’이다.
이 빛을 기록한 것이 바로 선 스펙트럼이다.

[ 그림 출처 commons.wikimedia.org ] 수소 원자의 전이 계열.
전자가 들뜬 후 이완 과정에서 선 스펙트럼이 발생하므로,
원자가 가진 전자의 수가 더 많을수록, 더 많은 선 스펙트럼이 관찰된다.
즉, 수소(H) 원자보다는 네온(Ne)의 선 스펙트럼이 훨씬 더 복잡하다.
[참고] 수소 원자의 전자는 1개인데 왜 수소 원자의 선 스펙트럼의 선은 4개인가요?
( 해설 https://ywpop.tistory.com/7431 )
[ 알칼리 금속 화합물의 불꽃 반응 ]

알칼리 금속 화합물은 무색이지만, 알칼리 금속 화합물을 물에 젖은 면봉에 뭍혀 불꽃에 넣으면 특정 색깔(파장)의 빛을 방출한다. Why?
[ 관련 글 https://ywpop.tistory.com/2996 ] 알칼리 금속 화합물의 불꽃 반응, Flame test

불꽃 속에서, 높은 온도로 인해,
ⓛ 알칼리 금속 이온은 기체 상태의 금속 원자로 환원된다.
② 금속 원자의 원자가전자는 열에너지를 흡수하여 바닥 상태에서 들뜬 상태로 전이한다. (들뜬다.)
③ 들뜬 상태로 전이한 전자는 빛의 형태로 에너지를 방출하면서 다시 바닥 상태로 되돌아온다.
④ ②, ③과정 반복.

[ 그림 출처 commons.wikimedia.org ] A demonstration of the 589 nm D2 (left) and 590 nm D1 (right) emission sodium D lines using a wick with salt water in a flame at the 2016 Cambridge Science Festival.
소금물에 심지를 담그고, 심지 끝을 알코올램프로 가열시켜,
나트륨(Na) 원자의 전자를 전이시켜 방출 스펙트럼을 측정하는 시연.
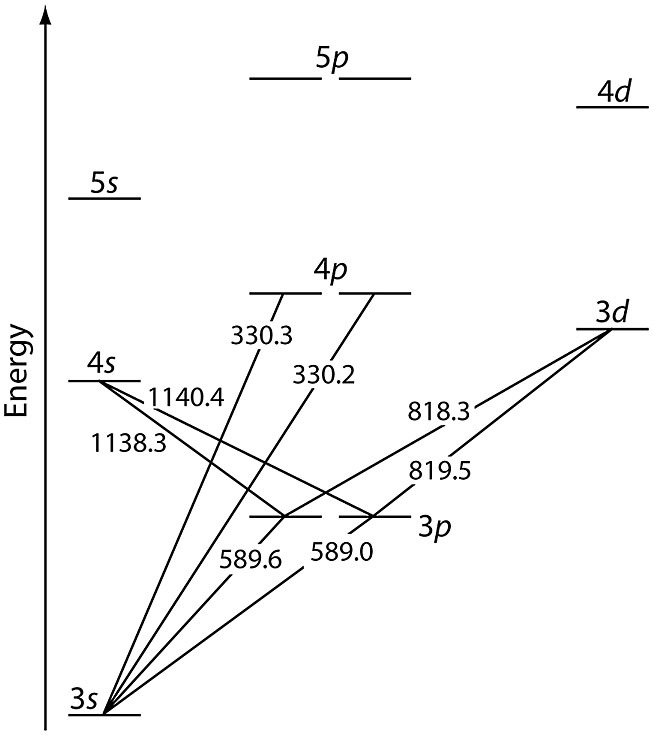
[ 그림 출처 chem.libretexts.org ] Grotrian diagram for sodium.
나트륨은 3s 오비탈에 1개의 원자가전자(최외각전자)가 존재한다.
( 나트륨(Na)의 바닥상태 전자배치: [Ne] 3s^1 )
나트륨의 불꽃 반응에서 관찰되는 노란색 빛은
바로 이 3s 전자가 들떴다가 다시 떨어질 때(내려올 때) 나오는 빛이다.
즉, 3p → 3s 전이(가시광선 영역, 589 nm)에 해당한다.
( 나트륨 전등 빛이 노란색인 이유도 이것 때문이다. )
여기서 주목할 점은, 나트륨 역시 수소처럼 다양한 전이가 존재한다는 것이다.
즉, 3p → 3s 전이뿐만 아니라,
4p → 3s 전이(자외선 영역),
4s → 3p 전이(적외선 영역),
3d → 3p 전이(적외선 영역)도 일어난다.
[ 관련 글 https://ywpop.tistory.com/8545 ] 선 스펙트럼. 흡수 스펙트럼과 방출 스펙트럼
[ 관련 글 https://ywpop.blogspot.com/2024/05/why-do-atoms-emit-light.html ]
Why do atoms emit light? 원자가 빛을 방출하는 이유
[키워드] 선 스펙트럼 기준문서, 원자 방출 스펙트럼 기준문서, 불꽃 반응 기준문서, 에너지 흡수와 방출 기준문서, 빛의 형태로 방출 기준문서, 빛의 형태로 에너지 방출 기준문서, 들뜸과 이완 기준문서
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 원자의 바닥상태 전자배치. 바닥상태 원자의 전자배치 (0) | 2017.09.24 |
|---|---|
| 수소 스펙트럼 계열. hydrogen spectral series ★ (0) | 2017.07.01 |
| 수소 원자의 선 스펙트럼. 4개의 선 스펙트럼 (1) | 2017.06.29 |
| 전자 배치의 축약. 축약형 전자 배치 ★ (0) | 2017.06.06 |
| 은 금속의 일함수는 436 kJ/mol (0) | 2017.05.24 |
| 수소 원자에서 전자가 방출하는 에너지와 파장. n=1 to n=∞ ★ (0) | 2017.05.24 |
| 하이젠베르크의 불확정성 원리 (Uncertainty Principle) (0) | 2017.05.24 |
| 빛의 에너지와 진동수, 파장 관계(예제) (2) | 2017.05.22 |


댓글