주양자수, n과 오비탈의 개수. 주양자수, n과 전자의 개수
---------------------------------------------------
▶ 참고: 한 벌의 양자수 [ https://ywpop.tistory.com/2932 ]
---------------------------------------------------
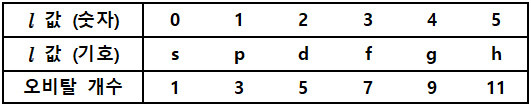
[1] n 값을 갖는 껍질 안에 들어있는 오비탈의 개수 = n^2 개
n = 1 이면, 1^2 = 1개 오비탈 ---> 1개 1s
n = 2 이면, 2^2 = 4개 오비탈 ---> 1개 2s + 3개 2p
n = 3 이면, 3^2 = 9개 오비탈 ---> 1개 3s + 3개 3p + 5개 3d
n = 4 이면, 4^2 = 16개 오비탈 ---> 1개 4s + 3개 4p + 5개 4d + 7개 4f
[2] n 값을 갖는 껍질 안에 들어있는 전자의 최대 개수 = 2 × n^2 개
> 1개 오비탈에 최대 2개 전자가 채워지므로(들어가므로)
n = 1 (K 껍질)이면, 2 × 1^2 = 2개 전자까지 채울 수 있다.
n = 2 (L 껍질)이면, 2 × 2^2 = 8개 전자까지 채울 수 있다.
n = 3 (M 껍질)이면, 2 × 3^2 = 18개 전자까지 채울 수 있다.
n = 4 (N 껍질)이면, 2 × 4^2 = 32개 전자까지 채울 수 있다.
( 단, 껍질당 최대 전자 개수는 원자 자신 혼자만의 전자 개수가 아님에 주의.
원자 자신 혼자는 최대값만큼 전자를 갖고 있지 않다.
즉, 원자 상태에서는 최대값만큼 전자를 절대로 가질 수 없다.
껍질당 최대 전자 개수는 분자 상태에서 결합에 참여한 자신의 전자와
결합에 참여한 상대편 원자의 전자의 합을 의미한다. )
( 참고 https://ywpop.tistory.com/7591 )


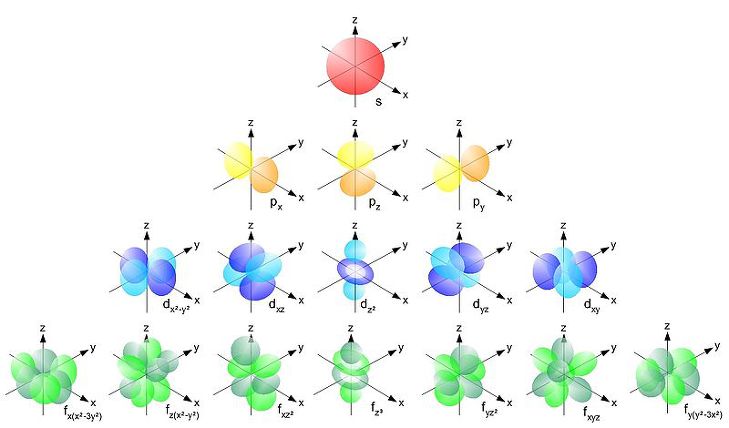
[ 그림 출처 Wikimedia ] 오비탈의 모양과 개수.
s 오비탈은 1개, p 오비탈은 3개, d 오비탈은 5개, f 오비탈은 7개.
> s 오비탈의 개수 = 1개
> p 오비탈의 개수 = 3개
> d 오비탈의 개수 = 5개
> f 오비탈의 개수 = 7개
[키워드] 오비탈의 개수 기준문서, 2 8 8 기준문서, 2 8 18 기준문서, 주양자수와 오비탈 개수 기준문서, 최대 전자 개수 기준문서, 최대로 채울 수 있는 기준문서, 최대로 채울 수 있는 전자 기준문서, 원자 궤도함수의 수 기준문서, 원자 궤도함수의 개수 기준문서, 원자 오비탈의 수 기준문서, 원자 오비탈의 개수 기준문서, 원자 궤도함수의 수 사전, 원자 궤도함수의 개수 사전, 원자 오비탈의 수 사전, 원자 오비탈의 개수 사전
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 수소 원자의 에너지 준위 차이 ★ (2) | 2017.04.29 |
|---|---|
| 다전자원자 오비탈의 에너지 준위. (n+l) 규칙 (0) | 2017.04.06 |
| 전자기 복사선의 일반적인 파장 단위 (0) | 2017.03.23 |
| 수소 원자 오비탈의 에너지 준위 간격과 거리 간격 (1) | 2017.03.20 |
| 수소 원자의 n번째 궤도의 에너지 계산식 (0) | 2017.02.27 |
| 1 eV 운동에너지 갖는 전자의 드브로이 파장 (1) | 2017.02.01 |
| 20 eV 운동에너지 갖는 전자의 드브로이 파장 (0) | 2017.02.01 |
| 전자(오비탈)의 퍼텐셜 에너지 준위와 전자의 안정도 (2) | 2016.10.20 |


댓글