한 벌의 양자수. a set of quantum numbers
---------------------------------------------------
▶ 참고: 제6장 원자의 전자 구조. 목차
[ https://ywpop.tistory.com/15222 ]
---------------------------------------------------
[파동 방정식과 양자수]
( https://ywpop.tistory.com/7108 )
---> 이 글을 먼저 읽어보길 권장합니다.
[1] 주양자수 (principal quantum number, n)
▶ 오비탈의 크기 결정. ‘껍질 (shell)’
▶ n = 1, 2, 3, ... : 정수
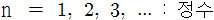

( 참고: 전자껍질의 이름이 K부터 시작하는 이유 https://ywpop.tistory.com/2987 )
( 참고: 각 전자껍질당 최대 전자수 (2n^2) https://ywpop.tistory.com/8889 )
[2] 각운동량(angular momentum) 양자수 (l)
▶ 오비탈의 모양 결정. ‘부껍질 (subshell)’, 부양자수, 방위 양자수
▶ l = 0, 1, 2, 3, ..., (n–1) : 정수
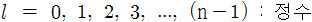
▶ 주양자수의 숫자와 쉽게 구분되도록,
각운동량 양자수는 숫자에 대응하는 문자(기호)로 나타낸다.

( 참고: 부양자수 보충 설명 https://ywpop.tistory.com/10899 )
( 오비탈의 모양이 화학 결합과 결합각에 영향을 주기 때문에,
“화학적으로 매우 중요한 양자수”. )
[3] 자기(magnetic) 양자수 (m_l)
▶ 오비탈의 공간 배향(orientation) 결정.
▶ 부껍질 내 오비탈의 개수 결정.
▶ m_l = –l, ..., 0, ..., +l : (2l + 1)개의 정수

> l = 0 → s. 따라서 s 오비탈은 1개.
> l = 1 → p. 따라서 p 오비탈은 3개. [ –1, 0, +1 ]
[ p_x, p_y, p_z ]
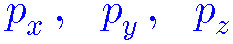
> l = 2 → d. 따라서 d 오비탈은 5개. [ –2, –1, 0, +1, +2 ]
[ d_xy, d_yz, d_xz, d_x^2-y^2, d_z^2 ]
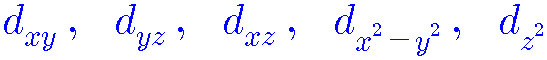
> l = 3, 즉 f 오비탈이면,
–3, –2, –1, 0, +1, +2, +3 이므로, 총 7개 오비탈.
> l = 4, 즉 g 오비탈이면,
–4, –3, –2, –1, 0, +1, +2, +3, +4 이므로, 총 9개 오비탈.
[참고] 3개의 p 오비탈은
모두 에너지 준위가 같고,
모두 모양도 같기 때문에,
서로 구별할 수 없다.
이 때문에, 편의상, 순서대로,
p_x = –1, p_y = 0, p_z = +1
이라 사용한다.
[참고] 3개의 p 오비탈은
모양도 같고, 에너지 준위도 같지만,
공간에서의 배향(방향)이 다르다.
각각 x축, y축, z축 상에 놓여있다.
이 때문에 p 오비탈의 기호도
각각 p_x, p_y, p_z로 표기하여 구분하고 있다.
( 오비탈 그림 https://courses.lumenlearning.com/cheminter/chapter/orbitals/ )
[4] 스핀(spin) 양자수 (m_s)
▶ 파동 방정식의 해와 무관한 양자수.
▶ 실험을 통해 관찰된 결과.
▶ 단지, 전자의 스핀 상태를 나타냄.
▶ m_s = +1/2, –1/2 : 각각 ↑(업 스핀), ↓(다운 스핀)에 해당


※ 전자는, 지구처럼, 원자핵 주위를 공전도 하고 스스로 자전도 하는데,
자전 방향이 어떤 전자는 시계 방향, 다른 전자는 반시계 방향으로
각기 다르게 회 전 하 더 라. (실험하다가 관찰된 자연 현상)
---> 스핀 양자수는 자전(회전) 방향이 다른 전자들을 구분하기 위해 필요하다는 것,
고등학생, 대학 학부생들은 오로지 이것 하나만 알고 있으면 된다.
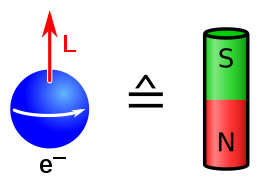
[ 그림 출처 Wikimedia ] 화살표 방향과 회전 방향의 관계는 중요하지 않다.
( 구글에서 검색하면, N→S, S→N, 둘 다 검색된다. )
업 스핀(= 업 화살표, ↑)은 +1/2,
다운 스핀(= 다운 화살표, ↓)은 –1/2, 이것만 반드시 기억하자.
[보충]
(1) 지구가 태양 주위를 공전하면서, 또한 자전하듯이,
전자 역시 원자핵 주위를 공전하면서, 또한 자전하는데,
이와 같은 “전자의 자전을 전자 스핀”이라 한다.
(2) 어떤 전자는 공전 방향과 같은 방향으로 자전하고,
다른 전자는 공전 방향과 반대 방향으로 자전하는데,
각각의 전자를 업 스핀(↑), 다운 스핀(↓)으로 구분한다.

> p 오비탈은 n=2인 전자껍질부터 존재한다.
> d 오비탈은 n=3인 전자껍질부터 존재한다.
( n=1인 전자껍질에는 s 오비탈만 존재한다. )
[참고]
Q. 주양자수가 n일 때, 왜 방위양자수의 개수는 [0, n–1개]인가?
(또는) s 오비탈의 방위 양자수는 0이고, p 오비탈은 1이라는데,
이것을 2~3학년 고등학생 수준으로 설명해 주세요.
A. 이것은 그냥 외우는 것이지, 이해하는 것이 아닙니다.
물리/화학을 전공하는 2~3학년 정도의 대학생도
이것을 이론적으로 이해(설명)할 수 있는 사람은 거의 없습니다.
이것을 이론적으로 설명하려면,
“완전 어려운” 양자역학을 이해할 수 있어야 하기 때문입니다.
그런데 중요한 것은 이것을 굳이 이해할 필요도 없다는 것입니다.
주양자수가 n일 때, 방위양자수의 개수는 [0, n–1개],
그냥 아주 간단한 이것만 외우면, 골치 아픈 양자역학을 몰라도,
고급 과정의 물리/화학을 공부하는데 전혀 문제가 없기 때문입니다.
이것을 저는 학생들에게 다음과 같이 비유적으로 설명합니다.
자동차 ‘운전’을 배우려는 사람이
자동차 엔진 룸에 있는 엔진의 기계적 구조와 작동원리, 그리고
각종 전자제어장치의 작동원리를 이해하려고 하는 것과 같다.
물론 기계공학 지식과 전자공학 지식을 알고 있다면,
자동차를 운전하다가 문제가 발생했을 때
어느 정도 도움이 될 수는 있겠지만,
그렇다고 이런 지식들을 모른다고 해서
자동차 ‘운전’을 못하는 것은 아니다.
운전석에 앉아서 시동 걸 줄 알고,
액셀러레이터를 밟으면 차가 움직이고,
브레이크를 밟으면 차가 선다는
이 간단한 원리만 이해하면 자동차는 누구나 운전할 수 있다.
[추가] 주양자수가 n일 때, 왜 방위양자수의 개수는 [0, n–1개]인가?
그래도 진정으로 이것을 이해하고 싶다면,
고등학교와 대학을 졸업하고 대학원에 진학해서 ‘양자역학’을 전공하세요.
---------------------------------------------------
지금까지 설명한 4개의 양자수를 다음과 같이 괄호로 묶어
한 개의 set으로 나타낼 수 있다.
(주양자수, 각운동량 양자수, 자기 양자수, 스핀 양자수)
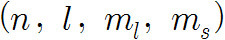

[주의할 것] 부껍질 내 각 오비탈의 에너지 준위는 동등(동일)하다.
예를 들어, 3개 p 오비탈의 에너지 준위는 동등하므로,
각각의 p 오비탈은 서로 구분할 수 없다.
[ 관련 글1 https://ywpop.tistory.com/8967 ]
[ 관련 글2 https://ywpop.tistory.com/9340 ]
---------------------------------------------------
▶ 전자배치 표기법. 오비탈 표기법
( 전자배치 표시법. 오비탈 표시법 )
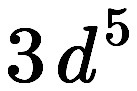
> 앞의 숫자 3의 의미: 주양자수, 껍질, 주기, 에너지 준위
> 문자 d의 의미: 각운동량 양자수, 부껍질, 방위 양자수, 오비탈 모양
> 뒤의 숫자 5의 의미: 오비탈에 존재하는 전자 수
---------------------------------------------------
▶ 바닥상태 원자의 마지막 전자의 양자수 set
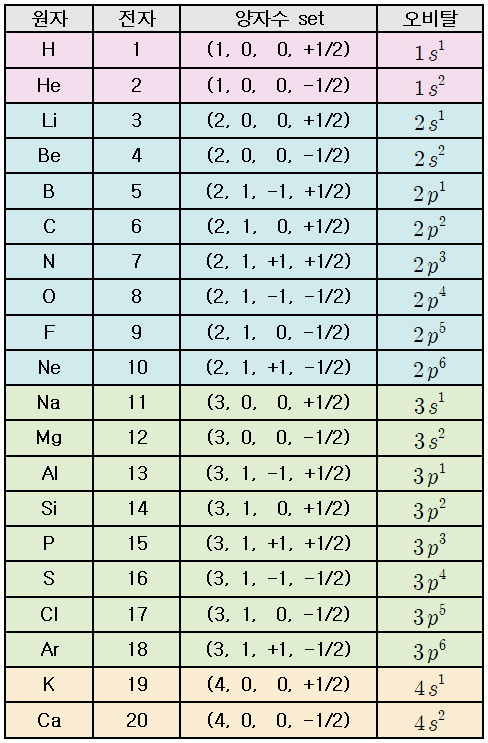
[참고] 원자 오비탈에 전자를 채우는 방법
[ https://ywpop.tistory.com/2840 ]
[1] 쌓음 원리 (Aufbau principle, 축조 원리)
[2] 파울리의 배타 원리 (Pauli exclusion principle)
[3] 훈트 규칙 (Hund’s rule)

[ 관련 글 https://ywpop.blogspot.com/2024/04/how-many-electrons-are-present-in-shell.html ]
How many electrons are present in each shell, subshell, or orbital?
a. a 2p orbital
b. the 3d subshell
c. a 3d orbital
d. the third shell
[키워드] 한 벌의 양자수 기준, 한 벌의 양자수 사전
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 입자가속기 내 전자의 파장. 빛의 속도의 99% (4) | 2015.03.31 |
|---|---|
| 전자기파. electromagnetic wave (4) | 2015.03.12 |
| 수소 원자에서 전자가 방출하는 에너지와 파장. n=3 to n=2 ★ (5) | 2015.01.06 |
| 왜 전자 껍질(오비탈)의 이름이 K L M N일까요? (1) | 2014.11.14 |
| 양자(quantum)와 양자 역학(quantum mechnics)에 대한 짧은 개념 (1) | 2014.10.25 |
| 오비탈의 축퇴, degenerate orbital (0) | 2014.10.24 |
| 원자 오비탈의 전자 배치 순서의 예외, 크롬(Cr)과 구리(Cu) ★ (7) | 2014.10.03 |
| (n+l) 규칙. 원자 오비탈의 에너지 준위, 전자 배치 순서 ★ (2) | 2014.10.02 |

댓글