원소분석 및 질량분석 결과로부터 분자식 구하기
원소분석 결과로부터 실험식을 구하고,
실험식과 질량분석 결과로부터 분자식을 구합니다.
( 즉, 질량분석 결과인 분자량 없이는 분자식을 구할 수 없습니다. )
A. 원소분석 결과

( 일반적인 원소분석 시료의 양: 5~10 mg )
C : 61.2891%, H : 5.0477%, O : 32.1723%
기기분석 결과 중에서 아마도 원소분석 결과가 제일 간단할 듯...
각 성분 원소의 질량 함량 퍼센트(조성 백분율)가 다입니다.
합이 정확하게 딱 100%가 안 되는 것은 잡다한 실험 오차 때문입니다.
( 예를 들면, 시료의 순도, 원소분석 기기장치내 오염(청소불량)에 의한 오차,
원소분석 기기장치 자체의 오차, 오퍼레이터의 조작 미숙에 의한 오차 등... )
이제 이 질량 함량 퍼센트 결과를 가지고 실험식을 만들어 봅시다.
실제 실험에 사용한 시료의 질량은 5~10 mg 정도이지만,
시료의 질량을 100 g이라고 가정합니다.
그러면, 원자의 질량 함량 퍼센트를 그대로 원자의 질량으로 쓸 수 있고,
이렇게 하면, 원자의 질량과 몰질량으로부터 몰수를 계산할 수 있습니다.
> C의 질량: 61.2891% = 61.2891 g
> H의 질량: 5.0477% = 5.0477 g
> O의 질량: 32.1723% = 32.1723 g
[질량으로부터 몰수 계산] 질량 / 몰질량 = 몰수
> C의 몰수: 61.2891 g ÷ (12.01 g/mol) = 5.103 mol C
> H의 몰수: 5.0477 g ÷ (1.008 g/mol) = 5.008 mol H
> O의 몰수: 32.1723 g ÷ (16.00 g/mol) = 2.011 mol O
( 참고: n=W/M https://ywpop.tistory.com/7738 )
대부분 실험 오차 때문에 딱 떨어지는 정수가 바로 구해지지는 않습니다.
이때 약간의 수학적 센스가 필요한데 (시행착오(trial and error) 방법),
이번 실험에선 비교적 쉽게 아래와 같은 실험식을 구할 수 있습니다.
[몰수의 가장 작은 정수비 계산] 가장 작은 몰수로 나누기
C : H : O = 5.103 : 5.008 : 2.011 ≒ 5 : 5 : 2
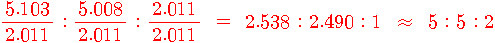
실험식 = C5 H5 O2
여기서 몰수비 = 개수비 이고,
원자는, 정의상, “쪼갤 수 없는 물질”이므로,
몰수비는 1.5, 1.67, 2.5 와 같은 소수점을 가질 수 없다.
이 때문에 정수 또는
2.9, 4.1 과 같이 거의 정수에 가까운 숫자가 나올 때까지,
( 실험 오차로 인해 딱 떨어지는 정수가 나올 확률은 0에 가깝다. )
×2, ×3, ×4, ... 해서,
몰수의 가장 작은 정수비를 구한다.
[ 관련 예제 https://ywpop.tistory.com/21277 ] ×2, ×3,... 해서 실험식 구하기
B. 질량분석 결과
( 참고: 질량 분석법 https://ywpop.tistory.com/2746 )
Mass of molecular ion : 194
---> 분자량
(1) 실험식량 계산 = 5(12.01) + 5(1.008) + 2(16.00) = 97.10
(2) 분자량 / 실험식량 = 194 / 97.10 = 1.998 ≒ 2 = n
분자식 = n(실험식) = 2 × (C5 H5 O2) = C10 H10 O4
[참고] 원소분석, 질량분석 결과로부터 분자식(CxHyOz) 계산 공식
x = 분자량 × (C의 조성백분율/100) / 12
y = 분자량 × (H의 조성백분율/100) / 1
z = 분자량 × (O의 조성백분율/100) / 16
x = 194 × (61.2891/100) / 12 = 9.91 ≒ 10
y = 194 × (5.0477/100) / 1 = 9.79 ≒ 10
z = 194 × (32.1723/100) / 16 = 3.90 ≒ 4
[참고] 원소 분석 결과로부터 실험식을 결정할 때,
왜 시료의 질량을 100 g이라고 가정할까?
왜 시료의 질량을 100 g이라고 가정하면,
[성분 원소의 질량 백분율 값 = 성분 원소의 질량 값]으로 사용해도 될까?
---------------------------------------------------
예를 들어,
시료에 실제로 탄소가 3 g, 수소가 1 g 들어있다면,
시료 중 탄소의 함량은
[3 / (3+1)] × 100 = 75%
시료 중 수소의 함량은
[1 / (3+1)] × 100 = 25%
가 됩니다.
따라서
탄소 : 수소 = 3 g : 1 g = 75 g : 25 g
으로 질량 비가 성립하기 때문입니다.
즉, 시료에 들어있는 탄소와 수소의 실제 질량은 모르지만,
원소 분석 결과인 각 성분의 질량 백분율이
실제 각 성분의 질량 비와 일치하기 때문에,
[성분 원소의 질량 백분율 값 = 성분 원소의 질량 값]
으로 사용해도 됩니다.
[참고] 원소분석과 유효숫자
원소분석 결과는 다양한 오차 요인을 복합적으로 포함하고 있기 때문에,
( 가령 질량은 저울로 측정한 g 하나, 부피는 메스실린더로 측정한 mL 하나뿐... )
또한, 무엇보다, 원소분석 결과로부터 실제로 구하는 것은
각 원자의 가장 작은 “정수”비이기 때문에,
실제 원소분석 결과를 다룰 때는 유효숫자 처리를 하지 않습니다.
( 원소분석 자료와 무관하게 소수점 이하 4~6째 자리까지 사용합니다. )
옛날(?) 제가 실험실에 있었을 때는 엑셀 등으로 공식처럼 만들어서
함량(%)만 입력하면 자동으로 정수비가 나오도록 만들어서 사용했습니다.
왜냐하면, 운이 나쁠 경우,
함량에 너무나 많은 오차가 포함되어 있어서
한 번의 계산에서 정수비가 나오지 않는 경우도 있기 때문입니다.
이때는 정수비가 나오도록 함량을 임의로 조절해주어야 하는데,
(시행착오(trial and error) 방법)
이 작업을 일일이 계산기로 하려면
시간과 에너지가 너무 많이 소모되기 때문입니다.
[ 관련 글 https://ywpop.tistory.com/9606 ] CH 연소분석
[ 관련 글 https://ywpop.tistory.com/2854 ] CHO 연소분석
[ 관련 글 https://ywpop.tistory.com/3116 ] CHN 연소분석
[키워드] 원소분석 기준, 원소분석 사전
'화학 > 원소(연소)분석' 카테고리의 다른 글
| 원소분석: 실험식, 분자식 구하기. CH3, C2H6 (0) | 2015.04.12 |
|---|---|
| 원소분석. B 78.14%, H 21.86%, mol mass 27~28 g (2) | 2015.04.09 |
| Dimethylhydrazine 연소분석. 실험식, 분자식 결정 (2) | 2015.01.01 |
| 구리(Cu) 88.82%, 산소(O) 11.18% 질량비로 구성된 화합물의 실험식 (0) | 2014.10.14 |
| 연소분석(원소분석) 결과와 분자량으로 실험식/분자식 구하기 (1) | 2014.10.10 |
| 연소분석. 2.500 g C,H,O 화합물 4.776 g CO2 2.934 g H2O ★ (0) | 2014.10.06 |
| 실험식 결정 (2) 원자 개수의 비 구하기 (0) | 2014.01.24 |
| 실험식 결정 (1) 원소 분석 (0) | 2014.01.24 |




댓글