원소분석. B 78.14%, H 21.86%, mol mass 27~28 g
보론(B)과 수소(H)의 이성분 화합물의 조성 백분율은 B 78.14%, H 21.86%이다.
화합물의 몰질량이 27 g과 28 g 사이인 것으로 결정되었다면,
이 화합물의 실험식과 분자식을 결정하시오.
(B의 몰질량 = 10.8 g/mol, H의 몰질량 = 1.0 g/mol)
A binary compound of boron and hydrogen has the following percentage composition: 78.14% boron, 21.86% hydrogen. If the molar mass of the compound is determined by experiment to be between 27 and 28 g, what are the empirical and molecular formulas of this compound?
---------------------------------------------------
▶ 참고: 원소분석 [ https://ywpop.tistory.com/64 ]
---------------------------------------------------
사용된 시료의 질량을 100 g이라 가정하면, % → g
> B 78.14% → 78.14 g
> H 21.86% → 21.86 g
① 각 성분의 몰수 계산
> B의 몰수 = 78.14 g / (10.8 g/mol) = 7.2352 mol
> H의 몰수 = 21.68 g / (1.0 g/mol) = 21.68 mol
② 몰수의 가장 작은 정수비 계산
B : H = 7.2352 : 21.68
= 7.2352/7.2352 : 21.68/7.2352
= 1 : 2.9965
≒ 1 : 3
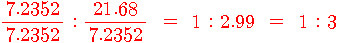
---> 실험식 = B H3
---> 실험식량 = (10.8) + 3(1.0) = 13.8
분자량 / 실험식량 = 27.5 / 13.8 = 1.9928 ≒ 2 = n
분자식 = n(실험식) = 2(B H3) = B2 H6
답: 실험식 = BH3, 분자식 = B2H6
[참고] 브로민과 수소의 이성분 화합물의 조성 백분율은 브로민 78.14%, 수소 21.86%이다. 화합물의 몰질량이 실험적으로 27 g과 28 g 사이인 것으로 결정되었다면, 이 화합물의 실험식과 분자식은 무엇인가?
---------------------------------------------------
Br의 몰질량 = 79.9040 g/mol ≒ 79.90 g/mol 이므로,
Br의 몰수 = 78.14 / 79.90 = 0.97797 mol
H의 몰수 = 21.68 g / (1.0 g/mol) = 21.68 mol
Br : H = 0.97797 : 21.68
= 0.97797/0.97797 : 21.68/0.97797
= 1 : 22.168
= 2 : 44.336
= 3 : 66.504
---> 답이 안 나온다.
---> 원서의 번역을 잘못한 case.
[키워드] 보론과 수소의 이성분 화합물, 78.14% Br 21.86% H mol mass 27~28 g
'화학 > 원소(연소)분석' 카테고리의 다른 글
| 연소반응 생성물로부터 실험식, 분자식 결정하기 (0) | 2015.04.27 |
|---|---|
| 리비히(Liebig) 분석법에서 염화칼슘과 수산화칼륨의 순서 (2) | 2015.04.24 |
| 36.8% 질소와 63.0% 산소로 이루어진 화합물의 실험식: N2O3 (1) | 2015.04.20 |
| 원소분석: 실험식, 분자식 구하기. CH3, C2H6 (0) | 2015.04.12 |
| Dimethylhydrazine 연소분석. 실험식, 분자식 결정 (2) | 2015.01.01 |
| 구리(Cu) 88.82%, 산소(O) 11.18% 질량비로 구성된 화합물의 실험식 (0) | 2014.10.14 |
| 연소분석(원소분석) 결과와 분자량으로 실험식/분자식 구하기 (1) | 2014.10.10 |
| 연소분석. 2.500 g C,H,O 화합물 4.776 g CO2 2.934 g H2O ★ (0) | 2014.10.06 |



댓글