redox balance. Mg + O2 → MgO
산화-환원 반응 완성하기. Mg + O2 → MgO
마그네슘 연소반응
마그네슘을 공기 중에서 가열하면 산화마그네슘이 생성되는 반응
---------------------------------------------------
▶ 참고: 산화-환원 반응 균형 맞추기 (산성 용액)
[ https://ywpop.tistory.com/4264 ]
---------------------------------------------------

1. 반쪽 반응식 나누기
산화: Mg → MgO (Mg의 산화수는 0에서 +2로 증가, Mg는 산화됨.)
환원: O2 → MgO (O의 산화수는 0에서 –2로 감소, O2는 환원됨.)
( 참고: MgO의 산화수 https://ywpop.tistory.com/9622 )
2. 질량 균형 맞추기
산화: Mg + H2O → MgO + 2H^+
환원: O2 + Mg + 2H^+ → MgO + H2O
3. 전하 균형 맞추기
산화: Mg + H2O → MgO + 2H^+ + 2e^-
환원: O2 + Mg + 2H^+ + 2e^- → MgO + H2O
4. 주고받은(이동한) 전자 수 같도록 (이미 같음)
산화: Mg + H2O → MgO + 2H^+ + 2e^-
환원: O2 + Mg + 2H^+ + 2e^- → MgO + H2O
( Mg 1 mol당 이동한 전자는 2 mol. )
5. 반쪽 반응식 더하기. 끝.
2Mg + O2 → 2MgO

---------------------------------------------------

(1) 산화: 2Mg → 2Mg^2+ + 4e^-
(2) 환원: O2 + 4e^- → 2O^2-
마그네슘(Mg)은 전자를 잃고(주고),
산소(O2)는 그 전자를 얻었다(받았다).
( Mg 1 mol당 이동한 전자는 2 mol )
두 반쪽 반응식을 합하면, (전자는 소거된다.)
(3) 2Mg + O2 → 2Mg^2+ + 2O^2- → 2MgO
[참고] 전하 균형 맞추기
화살표 양쪽 전하의 합은 같아야 하므로,
2Mg → 2Mg^2+
2(0) ≠ 2(2+)
전자(e^-)를 추가해서
전하 균형을 맞춘다.
2Mg → 2Mg^2+ + 4e^-
2(0) = 2(2+) + 4(–1)
0 = 0
O2 → 2O^2-
(0) ≠ 2(–2)
전자(e^-)를 추가해서
전하 균형을 맞춘다.
O2 + 4e^- → 2O^2-
(0) + 4(–1) = 2(–2)
(–4) = (–4)
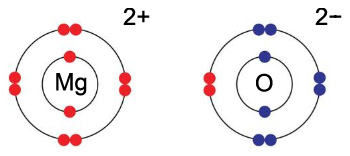
> 산화: Mg → Mg^2+ + 2e^-
> 환원: O + 2e^- → O^2-
> 전체: Mg + O → Mg^2+ + O^2- → MgO
[ 동일 예제 https://ywpop.tistory.com/9912 ]
[키워드] redox Mg + O2, redox O2 + Mg, redox MgO, 마그네슘의 연소 기준, Mg의 연소 기준, 마그네슘 연소 반응식 기준, Mg 연소 반응 기준, redox 2Mg + O2 → 2MgO, redox 2Mg(s) + O2(g) → 2MgO(s), redox Mg^2+ + O^2-
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 산화-환원 반응 균형 맞추기. 염기성 용액에서 (0) | 2016.11.27 |
|---|---|
| redox balance. Bi(OH)3 + SnO2^2- → SnO3^2- + Bi (basic) (0) | 2016.11.27 |
| redox balance. Cu + NO3^- → Cu^2+ + NO2 (acidic) (0) | 2016.11.27 |
| redox balance. Ag2S + Al → Ag + Al2S3 (0) | 2016.11.25 |
| redox balance. Fe2O3 + CO → Fe + CO2 (0) | 2016.11.20 |
| redox balance. NO2 + H2O → HNO3 + NO (0) | 2016.11.17 |
| redox balance. MnO4^- + I^- → MnO2 + I2 (basic) (2) | 2016.11.09 |
| redox balance. H2O2 + I^- → I2 + H2O (0) | 2016.11.07 |

댓글