SO3^2- 이온의 루이스 구조 그리기
아황산 이온(sulfite ion)의 루이스 구조
Lewis structure of SO3^2- ion
---------------------------------------------------
▶ 참고: 루이스 구조 그리기 [ https://ywpop.tistory.com/6302 ]
---------------------------------------------------
1. 각 원자의 원자가전자 수(와 이온의 전자 수)를 더한다.
SO3^2- = 4(6) + 2 = 26
2. 원자들을 배치시키고, 단일결합으로 연결하고,
단일결합 수만큼 전자 수를 뺀다.
26 – 3(2) = 20
3. 주위원자부터 옥텟규칙에 맞도록 한 쌍씩 전자를 그린 다음,
그린 전자 수만큼 뺀다.
20 – 3(6) = 2
4. 중심원자도 옥텟규칙에 맞도록 한 쌍씩 전자를 그린다.
남아있는 전자가 부족하면, 주위원자의 비결합 전자를 당겨,
다중결합을 만든다.
5. 각 원자의 형식전하를 계산해서,
형식전하가 할당된 원자가 최소 개수가 되도록,
또한 할당된 형식전하가 최소 값이 되도록, 그린다.

① 중심 원자가 3주기 이상의 원자이고, and,
② 형식 전하를 없앨 수 있다면,
⇨ 8개 전자를 초과할 수 있다.
( ∵ d 오비탈을 결합에 이용할 수 있기 때문에 )
3주기 이상 원소는 최대 18개 전자까지 가질 수 있다.
---> 확장 팔전자 규칙 또는 18 전자 규칙
( 참고 https://ywpop.tistory.com/3752 )
형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)
( 참고 https://ywpop.tistory.com/2544 )
[왼쪽 아황산 이온의 형식전하]
> S의 형식전하 = 6 – 2 – 3 = +1
> O의 형식전하 = 6 – 6 – 1 = –1
> 각 원자의 형식전하의 합
= 1개 S(+1) + 3개 O(–1) = –2 = 이온 전하
[오른쪽 아황산 이온의 형식전하]
> blue S의 형식전하 = 6 – 2 – 4 = 0
> red O의 형식전하 = 6 – 4 – 2 = 0
> black O의 형식전하 = 6 – 6 – 1 = –1
> 각 원자의 형식전하의 합
= 2개 black O(–1) = –2 = 이온 전하
---> 더 안정한 SO3^2-의 루이스 구조
▶ 전자영역의 기하구조와 분자의 기하구조
> 중심원자 S의 전자영역 = 4개 이므로,
---> 중심원자 S의 혼성오비탈 = sp3
---> 전자영역의 기하구조 = 사면체
> AX3E1 유형이므로,
---> 분자의 기하구조 = 삼각뿔
( 참고 https://ywpop.tistory.com/11542 )
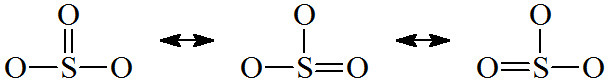
[그림] 아황산 이온의 공명 구조, Resonance structure SO3^2-.
※ 간단히 그리느라, 비결합전자쌍은 생략.

[그림] SO3^2-의 기하 구조.
trigonal pyramid molecular geometry.
NH3와 같은 삼각뿔 기하구조.
[참고] (B)와 (C) 구조가 SO3^2- 이온의 루이스 구조가 될 수 없는 이유
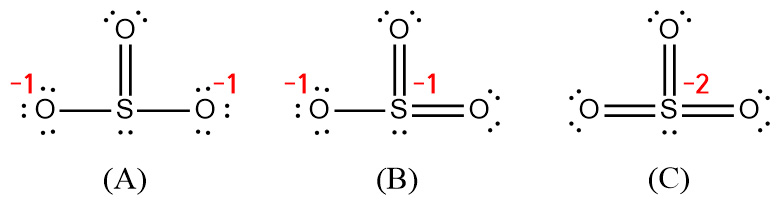
( 참고 https://ywpop.blogspot.com/2023/10/lewis-structure-of-so32-ion.html )
[ 관련 글 https://ywpop.tistory.com/3733 ] SO4^2-의 루이스 구조
[ 관련 글 https://ywpop.blogspot.com/2023/12/seo32.html ]
SeO3^2- 루이스 구조 그리기. Lewis structure of SeO3^2- ion
[키워드] SO3^2-의 루이스 구조 기준, 아황산 이온의 루이스 구조 기준, SO3^2- 루이스 기준
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 왜 정사면체는 쌍극자모멘트가 0인가요? (0) | 2015.09.02 |
|---|---|
| SOCl2 루이스 구조 그리기 (0) | 2015.07.13 |
| CS2 루이스 구조 그리기 (0) | 2015.07.11 |
| 클로로포름(Chloroform, CHCl3)의 루이스 구조 (0) | 2015.07.11 |
| 황산 이온(sulfate ion)의 루이스 구조 그리기 ★ (6) | 2015.07.08 |
| 루이스 구조(Lewis structure) 그리기. SO2 ★ (9) | 2015.06.15 |
| 분자의 자기적 성질. magnetic properties of molecules ★ (0) | 2015.03.13 |
| MO Diagrams of O2, F2, Ne2 (1) | 2014.12.06 |




댓글