루이스 구조(Lewis structure) 그리기. SO2
---------------------------------------------------
▶ 참고: 루이스 구조 그리기 [ https://ywpop.tistory.com/6302 ]
---------------------------------------------------



[그림] Sulfur dioxide, SO2, has two resonance structures.
SO2 분자의 공명 구조는 2개이다.

---> 이렇게 3개라고 생각하는 사람은
공명 구조라는 개념이 탄생한 이유, 즉
공명 구조의 정의부터 다시 공부해 보길 바란다.
( 참고: 공명 구조 https://ywpop.tistory.com/2635 )
O–S=O 구조와 O=S=O 구조의 안정성은 동등하지 않다.
Sulfur dioxide, SO2, has two resonance structures which contribute equally to the overall hybrid structure of the molecule. However, a third Lewis structure can be drawn for SO2 which is more stable in theory, but doesn’t quite match experimental data.
이산화황(SO2)은 분자의 전체 혼성 구조에 동등하게 기여하는 2개의 공명 구조를 가지고 있다. 그러나 이론적으로는 더 안정적이라고 여겨지는 세 번째 루이스 구조(O=S=O)도 그릴 수 있지만, 이는 실험 데이터와 완전히 일치하지 않는다.
---> 즉, 실제 SO2의 구조는 2개의 공명 구조를 가지는 구조이다.

[그림] SO2의 굽은형(bent) 구조. 결합각은 120도보다 작다.
( 참고: VSEPR https://ywpop.tistory.com/2571 )
▶ 전자영역의 기하구조와 분자의 기하구조
> 중심원자 S의 전자영역 = 3개 이므로,
---> 중심원자 S의 혼성오비탈 = sp2
---> 전자영역의 기하구조 = 삼각평면
> AX2E1 유형이므로,
---> 분자의 기하구조 = 굽은형
( 참고 https://ywpop.tistory.com/11542 )
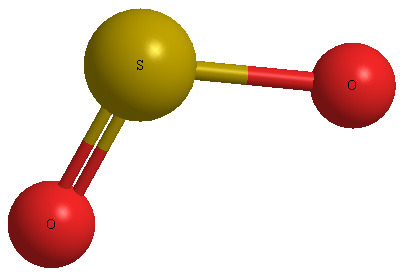
[그림] SO2 분자의 기하 구조.
[참고] SO2의 극성. SO2 polar or nonpolar
> 굽은형 구조이므로,
SO2는 극성 분자이다.
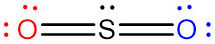
[ 참고: SO2의 두 번째 루이스 구조 https://ywpop.tistory.com/9838 ]
( SO2의 형식전하 계산 포함 )
[ 참고: SO3의 루이스 구조 https://ywpop.tistory.com/3820 ]
[ 관련 글 https://ywpop.blogspot.com/2024/05/lewis-structure-of-so2-so3-so32.html ]
SO2 SO3 SO3^2-에서 S–O 결합 길이 비교
[키워드] SO2의 루이스, SO2 루이스, 이산화황의 루이스
---------------------------------------------------
아래 기여 구조에서,
왼쪽 산소 원자(O)는 “비결합전자 수 = 6개 = 원자가전자 수” 이므로,
결합에 참여한(참여할) 전자가 없다.
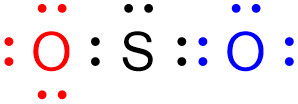
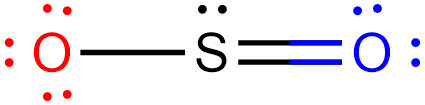
따라서
O–S 결합에서 결합전자는 황 원자(S)가 단독으로 제공한 전자이므로,
이 결합은 ‘배위 결합’에 해당된다.
‘coordinate bond (또는 dative covalent bond)’
[ 참고 chem.libretexts.org ]
▶ SO2에는 1개의 배위 결합이 존재한다.
[Google 검색 실적] 2021년 5월 인기 상승 페이지
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| CS2 루이스 구조 그리기 (0) | 2015.07.11 |
|---|---|
| 클로로포름(Chloroform, CHCl3)의 루이스 구조 (0) | 2015.07.11 |
| SO3^2- 이온의 루이스 구조 그리기 (6) | 2015.07.08 |
| 황산 이온(sulfate ion)의 루이스 구조 그리기 ★ (6) | 2015.07.08 |
| 분자의 자기적 성질. magnetic properties of molecules ★ (0) | 2015.03.13 |
| MO Diagrams of O2, F2, Ne2 (1) | 2014.12.06 |
| Lewis dot structure of H3PO4 (phosphoric acid) (0) | 2014.11.20 |
| 탄소(carbon), 산소(oxygen)의 혼성 오비탈(hybrid orbital) (6) | 2014.10.30 |




댓글