redox balance. MnO4^- + H2O2 + H^+ → Mn^2+ + O2 + H2O
산화-환원 반응 완성하기. MnO4^- + H2O2 + H^+ → Mn^2+ + O2 + H2O
---------------------------------------------------
▶ 참고: 산화-환원 반응 균형 맞추기 (산성 용액)
[ https://ywpop.tistory.com/4264 ]
---------------------------------------------------
산화된 물질과 환원된 물질을 파악한다.
( 팁: 산 촉매인 H^+, 염기 촉매인 OH^-, 용매인 H2O는 제외시킨다. )
( 추가설명 https://ywpop.blogspot.com/2023/12/redox-balance-mno4-h2o2-h-mn2-o2-h2o.html )
MnO4^- + H2O2 → Mn^2+ + O2
MnO4^-에서 Mn의 산화수 = +7
Mn^2+에서 Mn의 산화수 = +2
⇨ Mn은 산화수 감소, 환원됨.
( MnO4^-는, 즉 KMnO4는 산화제 )
H2O2에서 O의 산화수 = –1
O2에서 O의 산화수 = 0
⇨ O는 산화수 증가, 산화됨.
( H2O2는 환원제 )
> 산화제: MnO4^- (환원된 물질)
> 환원제: H2O2 (산화된 물질)
∴ Mn goes from oxidation number +7 to +2
and O goes from oxidation number –1 to 0.
( 참고: 산화수 구하는 규칙 https://ywpop.tistory.com/2719 )
산화된 물질과 환원된 물질을 파악했으면,
산화 반쪽 반응과 환원 반쪽 반응으로 나누고, 균형을 맞춘다.
---------------------------------------------------
(1) 각 반쪽 반응의 원자 수를 맞춘다.
( 질량 균형 맞추기 )
산화: H2O2 → O2 + 2H^+
환원: MnO4^- + 8H^+ → Mn^2+ + 4H2O
(2) 전자(e^-)를 사용하여 각 반쪽 반응의 전하 균형을 맞춘다.
( 전하 균형 맞추기 )
산화: H2O2 → O2 + 2H^+
(0) ≠ (0) + (+2) ⇨ (0) = (0) + (+2) + (–2)
⇨ 산화: H2O2 → O2 + 2H^+ + 2e^-
환원: MnO4^- + 8H^+ → Mn^2+ + 4H2O
(–1) + (+8) ≠ (+2) + (0) ⇨ (–1) + (+8) + (–5) = (+2) + (0)
⇨ 환원: MnO4^- + 8H^+ + 5e^- → Mn^2+ + 4H2O
(3) 두 반응의 전자 수가 같도록 곱한다.
( 주고받은(이동한) 전자 수 같도록 )
산화: H2O2 → O2 + 2H^+ + 2e^- (×5)
환원: MnO4^- + 8H^+ + 5e^- → Mn^2+ + 4H2O (×2)
⇨ 산화: 5H2O2 → 5O2 + 10H^+ + 10e^-
⇨ 환원: 2MnO4^- + 16H^+ + 10e^- → 2Mn^2+ + 8H2O
(4) 두 반응을 더한다. 완성.
( 반쪽 반응식 더하기 )
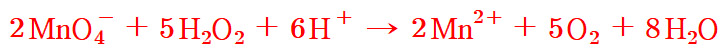
2MnO4^- + 5H2O2 + 6H^+ → 2Mn^2+ + 5O2 + 8H2O
[ 관련 예제 https://ywpop.tistory.com/5551 ]
2KMnO4 + 5H2O2 + 6HNO3 → 2Mn(NO3)2 + 5O2 + 2KNO3 + 8H2O
[ 참고 ] in basic solution,
2MnO4^- + 3H2O2 → 2MnO2 + 3O2 + 2H2O + 2OH^-
MnO4^-는 MnO2 고체로 환원된다.
[ 관련 자료 https://ywpop.tistory.com/7826 ]
산화: H2O2 → O2 + 2H^+ + 2e^-
> 1 mol H2O2 산화될 때, 2 mol 전자 이동.
---> H2O2의 당량수 = 2 eq/mol
환원: MnO4^- + 8H^+ + 5e^- → Mn^2+ + 4H2O
> 1 mol MnO4^- 환원될 때, 5 mol 전자 이동.
---> MnO4^-의 당량수 = 5 eq/mol
( KMnO4의 당량수 = 5 eq/mol )
[키워드] redox MnO4^- + H2O2, redox H2O2 + MnO4^-, H2O2의 당량수 기준, H2O2의 당량수 사전
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 전해전지. 소금 수용액의 전기분해 (0) | 2015.11.04 |
|---|---|
| 전기화학. 표준환원전위와 표준산화전위 ★ (1) | 2015.11.04 |
| 전하(電荷)와 전하량 (0) | 2015.08.04 |
| 다니엘 전지의 염다리, salt bridge (1) | 2015.05.26 |
| 소금의 전기분해. Electrolysis of sodium chloride (NaCl) ★ (2) | 2014.12.11 |
| 볼타 전지 간단 표기법. cell diagram. cell notation (1) | 2014.12.11 |
| 불균등화 반응. H2O2 산화-환원 반응 (0) | 2014.12.07 |
| redox balance. Br2 → BrO3^- + Br^- (acidic) (0) | 2014.11.26 |



댓글