화학식에 표시하는 숫자와 괄호의 의미. 원자단
---------------------------------------------------
▶ 참고: 제2장 원자, 분자, 이온. 목차
[ https://ywpop.tistory.com/15185 ]
---------------------------------------------------
화학식은 화합물을 구성하고 있는 원자의 상대적인 개수,
즉 화합물에 원자가 몇 개씩 존재하는지를
원소 기호와 숫자로 나타내는 방법 중 하나입니다.
( 참고 https://ywpop.tistory.com/2391 )
화합물이 분자라면 분자식이라고도 합니다.
화학식에서 원자는 원소 기호로 나타내고,
( 원소 주기율표에서 볼 수 있는 기호가 원소 기호입니다. )
원자의 개수는 원소 기호 바로 다음에 아래첨자로 표기합니다.
이때 원자가 1개 있다면, 즉 원자의 개수가 1이면,
1은 생략합니다.(나타내지 않습니다.)
예를 들어, 수소 원자(H) 2개와 산소 원자(O) 1개로 이루어진
물은 H2O로 나타냅니다.
( O의 개수를 나타내는 숫자 1은 생략. )
그리고 탄소 원자(C) 1개와 산소 원자(O) 2개로 이루어진
이산화탄소는 CO2로 나타냅니다.
( C의 개수를 나타내는 숫자 1은 생략. )
( 주의: CO2를 CO가 2개 있는 것으로 혼동하지 마세요. )

화학식(원소기호) 앞에 나오는 보통 크기 숫자(큰 숫자)는
분자 또는 원자의 개수를 나타내고,
원소기호 뒤에 나오는 아래첨자 숫자(작은 숫자)는
분자내 원자의 개수를 나타냅니다.
예를 들어, 2O는 산소 원자(O)가 2개 있다는 의미이며,
O2는 산소 분자가 1개 있다는 의미입니다.
( 산소 원자 2개가 화학 결합하여 산소 분자 1개가 됨. )
또한 3H2O는 물 분자(H2O)가 3개 있다는 의미입니다.

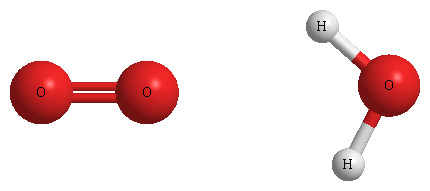
[그림] O2 분자 1개와 H2O 분자 1개.
예) 메탄올의 연소 반응식

수식 편집기를 사용하지 않는다면,
위 화학 반응식은 보통 다음과 같이 나타내며,
2CH3OH(l) + 3O2(g) → 2CO2(g) + 4H2O(l)
이렇게 나타낸 반응식을 봤다면,
> 화학식(원소기호) 앞에 나오는 숫자는 보통 크기 숫자(큰 숫자)이고,
> 원소기호 뒤에 나오는 숫자는 아래첨자 숫자(작은 숫자)임을 알고 있어야 합니다.
[참고] 2Cu + O2 → 2CuO 반응식의 이해
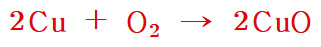
[ https://ywpop.tistory.com/20458 ]
[참고] 3Mg^2+ + 2N^3- → Mg3N2 반응식의 이해
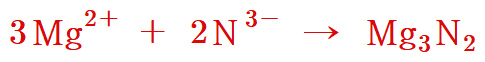
> 3Mg^2+: 3개의 Mg^2+ 이온
> 2N^3-: 2개의 N^3- 이온
> Mg3N2 에서,
숫자 3은 Mg 원자가 3개임을 나타내고,
숫자 2는 N 원자가 2개임을 나타낸다.
> 화살표 양쪽 Mg 원소의 개수는 3개로 서로 같다.
> 화살표 양쪽 N 원소의 개수는 2개로 서로 같다.
( 참고: 이온결합 화합물 화학식 쓰기 https://ywpop.tistory.com/7156 )
원자단
그럼 괄호는 언제, 어떻게 사용할까요?
괄호는 원자단에게만 사용합니다.
다원자 이온(polyatomic ions) / 작용기 / 리간드 등과 같이
여러 개의 원자가 모여 1개의 집단(group)을 만든 것을
“원자단(atomic group)”이라고 합니다.
원자단은 원자단을 구성하는 원자들끼리 강하게 결합되어있기 때문에
화학반응 시 원자단 전체가 반응에 참여합니다.
이 때문에 화학식에서 이들 원자단과 다른 원자를 구분할 필요가 있는데,
이때 괄호를 사용하는 것입니다.
[추가설명] 원자단의 정의
> 분자 내에 포함되어있는 원자의 집단
> 화합물 또는 분자 내에서 공유결합으로 결합되어있는 원자의 집단
리간드의 종류에는 H2O, NH3와 같은 중성 분자도 포함되어있는데,
( 참고: 몇 가지 리간드 https://ywpop.tistory.com/4811 )
그렇다고 중성 분자도 원자단에 포함된다고 생각하지는 마세요.
독립적으로 존재하는 안정한 중성 분자는 원자단에 포함되지 않습니다.
---> 이건 약간 헷갈릴 수 있군요.
일반적인 화학 반응식(화학식)에서는 중성 분자는 원자단이 아니다, 그렇지만,
배위화합물을 다루는 배위화학에서는 중성 분자가 리간드가 될 수 있으므로,
배위화학에서 나오는 화학 반응식(화학식)에서는 중성 분자도 원자단이다,
일단은 요정도만 정리하고 넘어갑시다. 초보 단계에서는 배위화학을 취급하지 않으므로...
( 참고: 다원자 분자의 정의 https://ywpop.tistory.com/9396 )
( 참고: 배위화합물 https://ywpop.tistory.com/7329 )
화학식에 원자단이 포함되어 있으면,
원자단을 원소 기호로 나타내고, 괄호로 묶습니다.
그리고 원자단의 개수는 괄호 바로 다음에 아래첨자로 표기합니다.
단, 원자단이 1개 있다면, 즉 원자단의 개수가 1이면,
괄호는 생략합니다.(나타내지 않습니다.)
예)
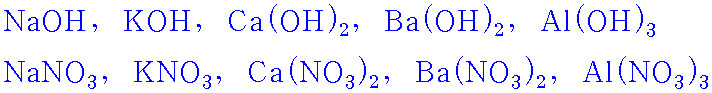
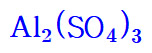
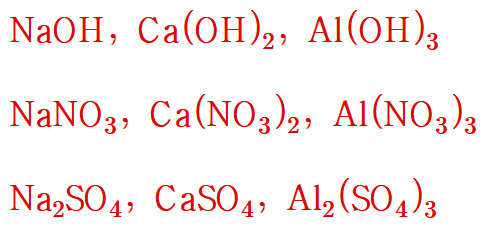
이 때문에,

시안화 이온(CN^-)
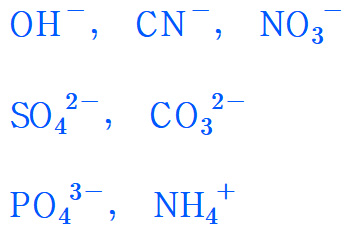
등과 같은 다원자이온은 몇 개 되지도 않기에 반드시 암기하도록 합니다.
( 암기해야 하는 이유 https://ywpop.tistory.com/6206 )
( 황산 이온의 루이스 구조식 https://ywpop.tistory.com/3733 )
원자단을 포함하는 몇 가지 화합물을 나타내보면,



[1석2조/1타2피] 대부분의 원자단은 산 또는 염기의 구성 성분이므로,
산 또는 염기의 이온화 반응식과 함께 암기하자.
( 참고: 산의 이온화 반응식 https://ywpop.tistory.com/10061 )
[ 관련 글 https://ywpop.tistory.com/3054 ]
[ 관련 글 https://ywpop.tistory.com/4728 ]
3원자 이상의 다원자 음이온의 명명법

Q. 예를 들어, NO3의 산화수(이온 전하)가 왜 –1인지 궁금합니다.
---------------------------------------------------
다원자이온(원자단)의 산화수는
1) 자신을 포함한 산의 이온화 또는
HNO3(aq) → H^+(aq) + NO3^-(aq)
( ^ 기호는 위첨자를 나타냅니다. 즉, ^ 기호 다음에 나오는 숫자 또는 문자는 위첨자입니다. )
2) 자신을 포함한 염의 이온화로 설명 가능합니다.
NaNO3(aq) → Na^+(aq) + NO3^-(aq)
또는 HNO3에서 H의 산화수(이온 전하)가 +1이기 때문에,
원자단인 NO3의 산화수(이온 전하)는 –1이 됩니다.
[ 관련 예제 https://ywpop.tistory.com/6752 ]
[ 관련 글 https://ywpop.tistory.com/11623 ] 시안화이온, CN^-는 왜 –1가 음이온인가?
[ 관련 글 https://ywpop.tistory.com/14656 ] HCO3^-의 이온 전하가 –1인 이유
---------------------------------------------------
끝으로, 화학 반응식을 보면,
2C4H10 + 13O2 → 8CO2 + 10H2O
화학식 맨 앞에 숫자가 붙어있는 것을 볼 수 있는데,
( CO2 앞에 붙어있는 8과 H2O 앞에 붙어있는 10과 같은 )
이 숫자는 분자의 개수를 나타냅니다.
( “화학량론적 계수”라고도 합니다. )
따라서
CO2 1개 분자에는 탄소 원자(C)가 1개, 산소 원자(O)가 2개 있기 때문에,
8CO2에 있는 탄소 원자의 개수는 총 8개, 산소 원자의 개수는 총 16개가 됩니다.

[ 관련 글 https://ywpop.blogspot.com/2023/10/h2so4-2h-so42.html ] 이온화 반응식 이해. H2SO4 → 2H^+ + SO4^2-

[키워드] 다원자 이온의 산화수 기준, 원자단의 산화수 기준, 위첨자 기호 기준, 기호 설명 기준, 원자단 기준, 원자단 사전
'일반화학 > [02장] 원자, 분자, 이온' 카테고리의 다른 글
| 화학식과 분자식의 정의 (0) | 2015.10.14 |
|---|---|
| 질량수 35 염소와 질량수 37 염소의 존재 비율 (2) | 2015.06.24 |
| isotopes of chlorine. Cl의 원자량 구하기 ★ (0) | 2014.12.16 |
| isotopes of titanium. 다섯 번째 동위원소의 질량 (0) | 2014.12.16 |
| 원자와 분자, 원소와 화합물 ★ (29) | 2014.11.14 |
| 이온과 이온 결합 화합물 (0) | 2012.06.11 |
| 원자번호 질량수 동위원소 ★ (0) | 2012.06.11 |
| 1803년 Dalton의 원자론 (0) | 2012.06.08 |


댓글