이온 결합 화합물 명명법. 음이온
---------------------------------------------------
▶ 참고: 이온 결합 화합물 명명법
[ https://ywpop.tistory.com/4729 ]
---------------------------------------------------
※ 음이온을 구성하는
“원자의 개수”에 따라,
“원소의 종류”에 따라,
음이온 명명‘법’이 다릅니다. ‘법’이므로,
이 ‘법’은 따로 암기해야 합니다.
a1) 단원자 음이온 : 원소 이름의 끝부분을 –ide(–화)로 바꾼다.
> H^- : 수소화(hydride) 이온
> O^2- : 산화(oxide) 이온
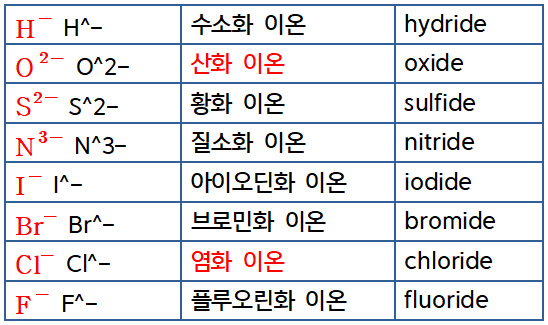
[ 추가 자료 https://ywpop.tistory.com/7881 ] 음이온 명명법
a2) 몇 가지 이원자 음이온도 –ide(–화)를 붙인다.
> OH^- : 수산화(hydroxide) 이온
> CN^- : 시안화(cyanide) 이온
( 기본적으로 1원자 음이온에 ~화를 붙이지만,
몇 가지 2원자 음이온도 ~화를 붙인다. )

[그림] 일반적인 음이온 (일부 자료).
[출처] Brown 일반화학 12판.
※ 3원자 이상의 다원자 음이온의 명명법은 아래와 같다.
b1) 산소를 포함하는 다원자 이온 : 끝에 –ate(–산) 또는 –ite(아~산)를 붙인다.
( 산소산 음이온 )
> NO3^- : 질산(nitrate) 이온
> NO2^- : 아질산(nitrite) 이온
예) NaNO3 질산나트륨(sodium nitrate), NaNO2 아질산나트륨(sodium nitrite)
예) Na2SO4 황산나트륨(sodium sulfate), Na2SO3 아황산나트륨(sodium sulfite)
> SO4^2-: 황산(sulfate) 이온
> SO3^2-: 아황산(sulfite) 이온
( 참고: 다양성자산 이온의 명명법 https://ywpop.tistory.com/21007 )
b2) [할로겐 + 산소] 음이온 : 예) Cl^-(chloride) + O
( 할로겐 산소산 음이온 )
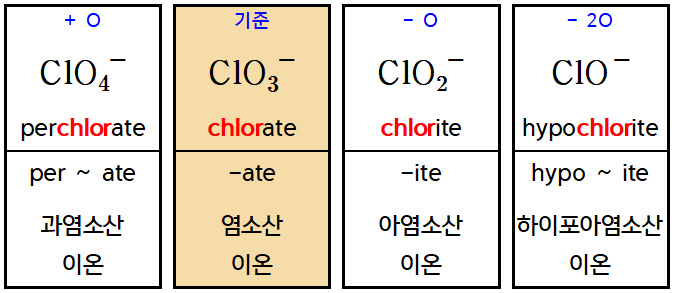
> 기준보다 산소(O) 원자 1개 더 많음: per ~ ate
> 기준 음이온: –ate
> 기준보다 산소(O) 원자 1개 더 적음: –ite
> 기준보다 산소(O) 원자 2개 더 적음: hypo ~ ite
c) [H^+ + 음이온] : 앞에 수소(hydrogen) 또는 이수소(dihydrogen)를 붙인다.
> CO3^2- : carbonate ion
> HCO3^- : hydrogen carbonate ion
> PO4^3- : phosphate ion
> H2PO4^- : dihydrogen phosphate ion
( 참고: 다양성자산 이온의 명명법 https://ywpop.tistory.com/21007 )
[ 관련 글 https://ywpop.tistory.com/23440 ] 셀레늄 음이온 명명법. selenium-containing anion
[ 관련 글 https://ywpop.tistory.com/3054 ] 무기화합물 음이온 명명법, –ide, –ate, –ite
[ 관련 글 https://ywpop.tistory.com/4729 ] 이온 결합 화합물 명명법
[키워드] 음이온 명명법 기준, 음이온 명명법 사전, 음이온 기준, 음이온 사전
'일반화학 > [02장] 원자, 분자, 이온' 카테고리의 다른 글
| 이성분 분자 화합물의 화학식과 명명법 ★ (2) | 2016.04.14 |
|---|---|
| 배수 비례의 법칙 ★ (0) | 2016.03.25 |
| 이온 결합 화합물과 원소 주기율표 외우기 ★ (0) | 2016.02.24 |
| 이온 결합 화합물 명명법 ★ (0) | 2016.01.23 |
| 이온 결합 화합물 명명법. 양이온 명명법 (0) | 2016.01.23 |
| 아스파탐(C14H18N2O5) 7.3 g에 들어있는 질소 원자의 개수 (1) | 2015.12.29 |
| 수소의 동위원소. isotopes of hydrogen (0) | 2015.11.07 |
| 화학식과 분자식의 정의 (0) | 2015.10.14 |


댓글