무기화합물 음이온 명명법, –ide, –ate, –ite
[1] 단원자 음이온
> 원소 이름의 끝부분을 –ide(–화)로 바꾼다.
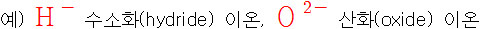
[2] 몇 가지 2원자 음이온
> –ide(–화)를 붙인다.

[3] 산소를 포함하는 다원자 이온
> 끝에 –ate(–산) 또는 –ite(아~산)를 붙인다.
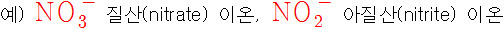
예) NaNO3 질산나트륨(sodium nitrate), NaNO2 아질산나트륨(sodium nitrite)
예) Na2SO4 황산나트륨(sodium sulfate), Na2SO3 아황산나트륨(sodium sulfite)
※ 기준 물질(가장 일반적인 물질, 가장 안정한 물질)에서
산소(O) 원자 1개가 빠진(감소한) 물질은
[아 + 기준 물질의 이름], 즉 기준 물질의 이름 앞에 ‘아’를 붙인다.
※ 대표적인(일반적인, 가장 많이 사용되는)
산소산의 음이온의 이름에 –ate를 붙이고,
여기서 산소(O)가 1개 빠지면, –ite를 붙인다.
[4] [할로겐+산소] 음이온. 할로겐 산소산의 음이온

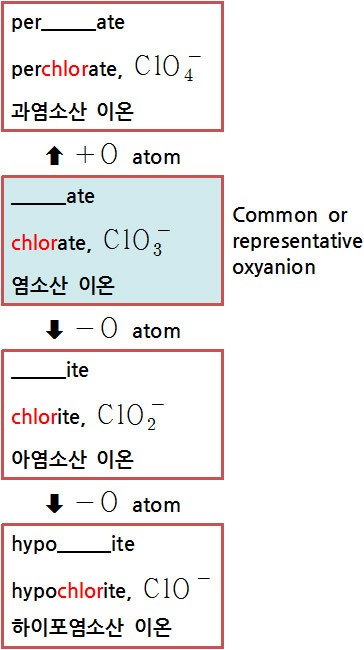
( 하이포아염소산 = 차아염소산 )
ex) four oxoacids that contain chlorine

> ClO4^– perchlorate ion → HClO4 perchloric acid
> ClO3^– chlorate ion → HClO3 chloric acid
> ClO2^– chlorite ion → HClO2 chlorous acid
> ClO^– hypochlorite ion → HClO hypochlorous acid
( 참고: 각 산의 루이스 구조 https://ywpop.tistory.com/8580 )
> HClO4: perchloric acid. 과염소산
> HClO3: chloric acid. 염소산
> HClO2: chlorous acid. 아염소산
> HClO: hypochlorous acid. 하이포아염소산
> HBrO4: perbromic acid. 과브로민산
> HBrO3: bromic acid. 브로민산
> HBrO2: bromous acid. 아브로민산
> HBrO: hypobromous acid. 하이포아브롬산
[ 관련 글 https://ywpop.tistory.com/4728 ] 이온 결합 화합물 명명법. 음이온
[키워드] 할로겐 산소산 명명법 기준, 이온 결합 화합물 명명법 기준, 음이온 명명법 기준, 할로겐 산소산 명명법 사전, 이온 결합 화합물 명명법 사전, 음이온 명명법 사전
'화학' 카테고리의 다른 글
| 원소의 기준 상태, reference state of an element (0) | 2014.12.09 |
|---|---|
| 이상기체 방정식과 기체의 분자량 (1) | 2014.12.09 |
| 뷰테인(부탄, butane, C4H10)의 연소 반응 (0) | 2014.12.08 |
| 산화-환원 반응 완성하기. Cr2O7^2- + Fe^2+ → Cr^3+ + Fe^3+ (0) | 2014.12.08 |
| 난용성염, Calcium hydroxide, Ca(OH)2 수용액의 pH (1) | 2014.12.07 |
| 산화-환원 반응 완성하기. Cu2O + NO3^- → Cu^2+ + NO (0) | 2014.12.07 |
| 0.068 M 시안화나트륨(사이안화소듐, sodium cyanide) 수용액의 pH (2) | 2014.12.06 |
| 정량분석. 산-염기 중화적정으로 NaOH 순도 결정 (0) | 2014.12.06 |




댓글