원자 오비탈의 전자 배치 순서의 예외, 크롬(Cr)과 구리(Cu)
( 원자번호 24번 크롬, 원자번호 29번 구리 )
---------------------------------------------------
▶ 참고: 제6장 원자의 전자 구조. 목차
[ https://ywpop.tistory.com/15222 ]
---------------------------------------------------
▶ (n+l) 규칙
> 일반적으로 원자 오비탈에 전자가 채워질 때는
(n+l) 규칙에 따라 전자가 채워진다.
( 참고: (n+l) 규칙 https://ywpop.tistory.com/2841 )
그러나 크롬 원자와 구리 원자에서 예외 현상이 발견된다.
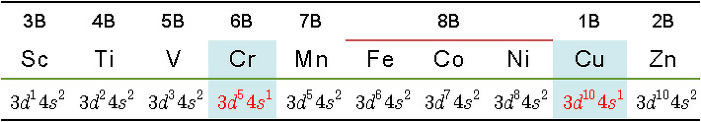
[표] 4주기 전이금속의 원자가전자
[ 관련 글 https://ywpop.tistory.com/2959 ] 왜 전이금속은 다양한 산화수를 가질까?
[ 관련 글 https://ywpop.tistory.com/2866 ] 원자가전자 결정하기
> 원자번호 21번 Sc의 전자배치: [Ar] 4s^2 3d^1
> 원자번호 22번 Ti의 전자배치: [Ar] 4s^2 3d^2
> 원자번호 23번 V의 전자배치: [Ar] 4s^2 3d^3
> 원자번호 24번 Cr의 전자배치: [Ar] 4s^1 3d^5
> 원자번호 25번 Mn의 전자배치: [Ar] 4s^2 3d^5
> 원자번호 26번 Fe의 전자배치: [Ar] 4s^2 3d^6
> 원자번호 27번 Co의 전자배치: [Ar] 4s^2 3d^7
> 원자번호 28번 Ni의 전자배치: [Ar] 4s^2 3d^8
> 원자번호 29번 Cu의 전자배치: [Ar] 4s^1 3d^10
> 원자번호 30번 Zn의 전자배치: [Ar] 4s^2 3d^10
▶ 크롬 원자의 바닥상태 전자배치

> (n+l) 규칙에 따르면,
4s 오비탈에 2개 전자, 3d 오비탈에 4개 전자가 배치되어야 한다.
> 그러나 실제는 4s 오비탈에 있던 전자 1개가 3d 오비탈로 전이하여,
3d 오비탈에 총 5개 전자가 배치된다.
( Cr 원자의 홀전자 개수 = 6개 )
▶ 구리 원자의 바닥상태 전자배치

> (n+l) 규칙에 따르면,
4s 오비탈에 2개 전자, 3d 오비탈에 9개 전자가 배치되어야 한다.
> 그러나 실제는 4s 오비탈에 있던 전자 1개가 3d 오비탈로 전이하여,
3d 오비탈에 총 10개 전자가 배치된다.
( Cu 원자의 홀전자 개수 = 1개 )
▶ Cr 원자와 Cu 원자가
(n+l) 규칙을 따르지 않는 이유를 간단히 설명하면,
d 오비탈에 전자가 절반 혹은 완전히 채워지는 것이,
원자 오비탈의 에너지 준위가 더 안정하기 때문이다.
즉, d 오비탈에 전자가 절반 혹은 완전히 채워지는 전자배치를
전자들이 더 선호한다는 것이다.
( 라고 현재 과학자들이 이렇게 설명하고 있다.
알려진 모든 원자의 바닥상태 전자배치는
‘원자 분광법’에 의해 실험적으로 결정된 것이며,
이 실험 결과를 놓고, 이렇게 설명하고 있다는 것이다. )
---------------------------------------------------
[크롬과 구리] 전자가 채워지는 순서 ≠ 전자를 잃는 순서
▶ 전자가 이온화될 때는
주양자수가 가장 큰 오비탈의 전자부터 이온화된다.
▶ 이온화될 때는 다른 원자들처럼
주양자수, n이 높은 오비탈에 있는 전자부터 잃는다.

> Cu^+ 이온의 전자배치: [Ar] 3d^10
▶ 그 이유는 3d 전자의 유효 핵전하가 훨씬 더 크기 때문이다.
이 때문에 이온화할 때는 4s 전자가 먼저 떨어져나간다.
( 참고: 유효핵전하 https://ywpop.tistory.com/2526 )
---------------------------------------------------
(n+l) 규칙에 따른 오비탈의 에너지 준위가
3d보다 4s가 더 낮기 때문에 (더 안정하기 때문에)
4s 오비탈부터 전자가 먼저 채워진다.
그러나 4s 오비탈의 주양자수가 더 크기 때문에,
( 전자가 채워지는 순서와 상관없이 )
가장 바깥에 있는 전자껍질에 속하는 오비탈은 4s이다.
전자가 이온화될 때 4s 전자부터 이온화되는 이유는
바로 이것 때문이다.
---> 가장 바깥 껍질의 전자부터 이온화된다.
[참고] 안타깝지만, 쌓음 원리(Aufbau principle)는
전자-전자 상호작용을 고려하지 않았기 때문에
모든 원자의 전자배치를 예측(설명)할 수 없다.
오비탈의 에너지 준위는 전자-전자 상호작용
(spin-orbit interaction 또는 spin-orbit coupling 포함) 을 고려한
양자역학적 계산을 통해 결정(설명)할 수 있다(결정해야 된다).
따라서 Nb, Mo와 같은 5주기 전이금속의 전자배치를
단순하게 설명할 수 있는 방법은 없다.
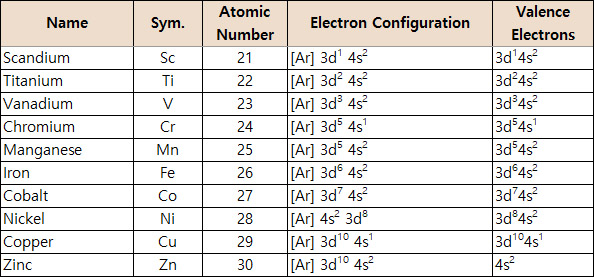
[그림] 4주기 전이금속의 원자가전자.
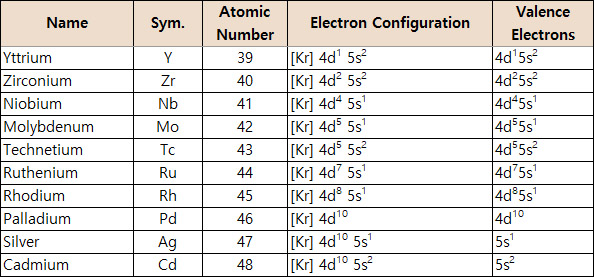
[그림] 5주기 전이금속의 원자가전자.
[ 관련 글 https://ywpop.blogspot.com/2024/06/ni-4s2-3d8-pd-5s2-4d8-4d10.html ]
Ni는 4s2 3d8인데, 왜 Pd는 5s2 4d8이 아닌 4d10인가요?
[ 관련 글 https://ywpop.tistory.com/5218 ] 4s 3d 순서? 3d 4s 순서?
[키워드] 전이원소 기준문서, 전이금속 기준문서, 원자 분광법 기준문서, 크롬과 구리와 크롬, 전자 배치 예외 기준문서, 크롬 전자배치 기준문서, 구리 전자배치 기준문서, 크롬의 전자배치 기준문서, 구리의 전자배치 기준문서, Cr의 전자배치 기준문서, Cu의 전자배치 기준문서, Cu의 원자가전자 기준문서, 구리의 원자가전자 기준문서, Cr의 원자가전자 기준문서, 크롬의 원자가전자 기준문서, 전이금속의 원자가전자 기준문서, 전이원소의 원자가전자 기준문서, 크롬의 전자배치 사전, 구리의 전자배치 사전, Cr의 전자배치 사전, Cu의 전자배치 사전
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 왜 전자 껍질(오비탈)의 이름이 K L M N일까요? (1) | 2014.11.14 |
|---|---|
| 한 벌의 양자수. a set of quantum numbers ★ (3) | 2014.10.29 |
| 양자(quantum)와 양자 역학(quantum mechnics)에 대한 짧은 개념 (1) | 2014.10.25 |
| 오비탈의 축퇴, degenerate orbital (0) | 2014.10.24 |
| (n+l) 규칙. 원자 오비탈의 에너지 준위, 전자 배치 순서 ★ (2) | 2014.10.02 |
| 원자 오비탈에 전자를 채우는 방법 (전자 배치 순서) ★ (7) | 2014.10.01 |
| 문턱. threshold (0) | 2013.04.08 |
| 파울리 배타 원리(배타율). Pauli exclusion principle ★ (0) | 2012.11.22 |


댓글