원자 오비탈에 전자를 채우는 방법 (전자 배치 순서)
---------------------------------------------------
▶ 참고: 제6장 원자의 전자 구조. 목차
[ https://ywpop.tistory.com/15222 ]
---------------------------------------------------
[1] 쌓음 원리 (Aufbau principle, 축조 원리)
▶ 에너지 준위가 가장 낮은(안정한) 오비탈부터 전자가 채워진다.
▶ 에너지 준위가 가장 낮은(안정한) 오비탈부터 전자를 채운다.
> 오비탈의 에너지 준위는 “(n + l) 규칙”으로 결정.
( 참고: (n + l) 규칙 https://ywpop.tistory.com/2841 )
[참고] 안타깝지만,
쌓음 원리는 “전자-전자 상호작용”을 고려하지 않았기 때문에
모든 원자의 전자 배치를 예측(설명)할 수 없다.
오비탈의 에너지 준위는 전자-전자 상호작용을 고려한
( spin-orbit interaction 또는 spin-orbit coupling 포함 )
양자역학적 계산을 통해 결정할 수 있다(결정해야 된다).
따라서 Nb, Mo와 같은 5주기 전이 금속의 전자 배치를
단순하게 설명할 수 있는 방법은 없다.
[2] 파울리의 배타 원리 (Pauli exclusion principle)
▶ 한 원자에 있는 어떤 두 전자라도 동일한 4개의 양자수를 가질 수 없다.
즉, 한 원자에서 4개의 양자수,
(n, l, m_l, m_s) 가 똑같은 전자는 있을 수 없다.
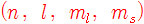
( 참고 https://ywpop.tistory.com/2023 )
예) 헬륨 원자의 전자 배치

(a) 첫째 전자의 양자수: (1, 0, 0, +1/2), 둘째 전자의 양자수: (1, 0, 0, +1/2)
→ 배타 원리 위배
(b) 첫째 전자의 양자수: (1, 0, 0, –1/2), 둘째 전자의 양자수: (1, 0, 0, –1/2)
→ 배타 원리 위배
(c) 첫째 전자의 양자수: (1, 0, 0, +1/2), 둘째 전자의 양자수: (1, 0, 0, –1/2)
→ 배타 원리 따름
(d) 첫째 전자의 양자수: (1, 0, 0, –1/2), 둘째 전자의 양자수: (1, 0, 0, +1/2)
→ 배타 원리 따름
일단 여기까지 보면, (a),(b) 배치는 불가능하고, (c),(d) 배치는 가능하다.
그러나 아래에 나오는 훈트 규칙에 따라 (d) 배치는 불가능하다.
따라서 실제 헬륨 원자의 전자 배치는 (c)와 같다.
[3] 훈트 규칙 (Hund’s rule)
▶ Hund’s rule of maximum multiplicity (최대 다중도 규칙)
( 참고 https://ywpop.tistory.com/9483 )
▶ 훈트 규칙: 에너지 준위가 같은 오비탈에 전자를 배치할 때,
즉 각운동량 양자수가 같은 오비탈에 전자를 배치할 때 적용되는 규칙.
① 짝짓지 않은 전자의 수가 최대가 되도록 채운다.
② up spin(↑) 전자를 먼저 채운다.
( 2가지 규칙 모두 만족해야 된다. )

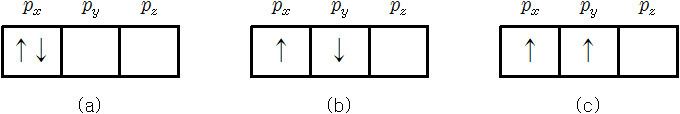
(a)는 “짝짓지 않은 전자의 수가 최대가 되도록 채운다”에 위배.
(b)는 “up spin 전자를 먼저 채운다”에 위배.
따라서 탄소 원자의 전자 배치는 (c)와 같다.
[참고] “up spin 전자를 먼저 채운다” 규칙을 제외하는 경우도 있다.
( 참고: 훈트 규칙 위배 고르기 https://ywpop.tistory.com/24044 )
[참고] 붕소(B)부터 산소(O)까지 2p 오비탈의 전자 배치는 다음과 같다.
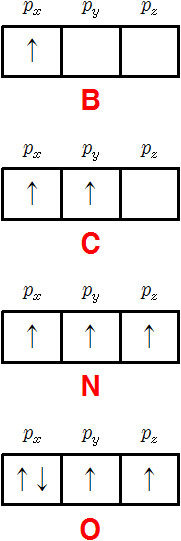
> B의 홀전자 개수 = 1
> C의 홀전자 개수 = 2
> N의 홀전자 개수 = 3
> O의 홀전자 개수 = 2
[주의할 것] 부껍질 내 각 오비탈의 에너지 준위는 동등(동일)하다.
예를 들어, 3개 p 오비탈의 에너지 준위는 동등하므로,
각각의 p 오비탈은 서로 구분할 수 없다.
[ 관련 글 https://ywpop.tistory.com/8967 ] (n, l, m)이 (2, 1, –1)인 오비탈의 이름
[ 관련 글 https://ywpop.tistory.com/9340 ] 원자 A~C의 전자배치



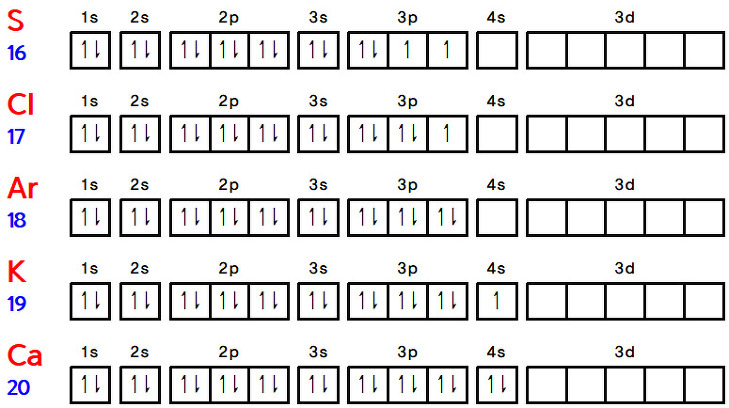


[ 관련 글 https://ywpop.tistory.com/15967 ]
[도표] 원자의 바닥상태 전자배치
[ 관련 글 https://ywpop.tistory.com/2844 ] Cr, Cu의 전자배치
[ 관련 글 https://ywpop.tistory.com/2932 ] 한 벌의 양자수
[ 관련 글 https://ywpop.tistory.com/3400 ] 원자의 바닥상태 전자배치 도표
[키워드] 바닥상태 전자배치 기준, 전자 채우기 기준, 쌓음 원리 기준, 파울리 기준, 배타 원리 기준, 훈트 규칙 기준, 바닥상태 전자배치 사전, 전자 채우기 사전, 쌓음 원리 사전, 파울리 사전, 배타 원리 사전, 훈트 규칙 사전
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 한 벌의 양자수. a set of quantum numbers ★ (3) | 2014.10.29 |
|---|---|
| 양자(quantum)와 양자 역학(quantum mechnics)에 대한 짧은 개념 (1) | 2014.10.25 |
| 오비탈의 축퇴, degenerate orbital (0) | 2014.10.24 |
| 원자 오비탈의 전자 배치 순서의 예외, 크롬(Cr)과 구리(Cu) ★ (7) | 2014.10.03 |
| (n+l) 규칙. 원자 오비탈의 에너지 준위, 전자 배치 순서 ★ (2) | 2014.10.02 |
| 문턱. threshold (0) | 2013.04.08 |
| 파울리 배타 원리(배타율). Pauli exclusion principle ★ (0) | 2012.11.22 |
| 원자의 구조. 원자의 구성 입자 ★ (0) | 2012.06.08 |




댓글