르 샤틀리에(Le Chatelier)의 원리. 부피/압력 변화
B. 부피/압력의 변화: 기체 분자를 포함하는 평형 계
[2] 부피가 고정되어 있을 경우
⇨ 가령, 반응 용기가 ‘강철 용기’라면,
압력이 변해도 부피는 변하지 않는다.
강철 용기 안에서 다음과 같은 평형이 유지되고 있을 때,

비활성 기체를 넣으면 어떻게 될까?
> 강철 용기이기 때문에,
전체 부피는 변함이 없을 것이다. (부피 일정)
> 강철 용기 안의 압력은 어떻게 될까?
즉, 계의 전체 압력은 증가할까? 감소할까?
추가된 비활성 기체 분자의 운동 때문에,
계의 전체 압력은 증가할 것이다.
그렇지만, 각 성분의 부분 압력은 변함이 없다.
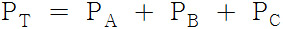
⇨ 돌턴의 부분 압력의 법칙
( 참고 https://ywpop.tistory.com/48 )
⇨ 계의 전체 압력 증가는 비활성 기체의 부분 압력 때문
따라서 다음과 같은 평형이
강철 용기 안에서 유지되고 있다면,


비활성 기체를 첨가해도,
평형은 그대로 유지된다. (아무 변화 없음)
※ 강철 용기 안에서
반응물/생성물의 부분 압력이 변하는지, 안 변하는지에 주목.
[보충 설명]
전체 압력을 증가시키는 다른 방법으로,
전체 부피의 변화 없이,
아르곤과 같은 비활성 기체를
반응 혼합물에 첨가하는 것이 있다.
이 경우 평형에 대한 영향은 완전히 다르다.
반응물과 생성물의 분압이
비활성 기체에 의해 변하지 않으므로,
일정 부피에서 아르곤의 첨가는
평형의 위치에 영향을 주지 않는다.
[출처] 옥스토비 일반화학 제6판(번역본) 제14장 화학 평형 683쪽.
[ 관련 글 https://ywpop.tistory.com/22916 ] 비활성 기체 첨가
[ 관련 글 https://ywpop.tistory.com/4134 ] 르샤틀리에 원리. 비활성기체와 평형 위치의 이동
[ A. 농도 변화 https://ywpop.tistory.com/2685 ]
[ B. 부피/압력 변화(1) https://ywpop.tistory.com/2686 ] PV = k
[ B. 부피/압력 변화(2) https://ywpop.tistory.com/2690 ] 강철 용기. 비활성 기체
[ C. 온도 변화 https://ywpop.tistory.com/2691 ]
[ 르샤틀리에의 원리 종합 예제 https://ywpop.tistory.com/12328 ]
[키워드] 르 샤틀리에 기준문서, 르 샤틀리에 원리 기준문서, 르 샤틀리에의 원리 기준문서, 평형 상수와 비활성 기체와 평형 상수, 화학 평형과 비활성 기체와 화학 평형, 평형 상수와 불활성 기체와 평형 상수, 화학 평형과 불활성 기체와 화학 평형, 르 샤틀리에 비활성 기체 기준문서
'일반화학 > [15장] 화학 평형' 카테고리의 다른 글
| 800 K I2(g) ⇌ 2I(g) Kc = 3.1×10^(-5) 10.0 L 2.67×10^(-2) g I(g) (2) | 2015.10.07 |
|---|---|
| 순수한 액체와 고체의 농도가 평형 상수 표현에 포함되지 않는 이유 ★ (0) | 2015.07.14 |
| 평형상수. 아세트산에틸(ethyl ethanoate)의 제조 (3) | 2015.05.17 |
| 평형에서의 농도. 일산화탄소와 수소 혼합물(합성가스) (0) | 2015.05.14 |
| 르 샤틀리에(Le Chatelier)의 원리. 온도 변화 (1) | 2014.07.18 |
| 르 샤틀리에(Le Chatelier)의 원리. 부피/압력 변화 (3) | 2014.07.16 |
| 르 샤틀리에(Le Chatelier)의 원리. 농도 변화 ★ (1) | 2014.07.15 |
| 화학 평형과 물리 평형 (0) | 2014.07.14 |




댓글