기체 혼합물과 돌턴의 분압 법칙
Dalton’s Law of Partial Pressure
기체 혼합물의 전체 압력은
각 기체가 홀로 존재할 때 작용하는 압력의 합과 같다.
Dalton’s Law, or the Law of Partial Pressures,
states that the total pressure exerted by a mixture of gases
is equal to the sum of the partial pressures of the gases in the mixture.
---------------------------------------------------
▶ 참고: PV = nRT [ https://ywpop.tistory.com/3097 ]
▶ 참고: n = W / M [ https://ywpop.tistory.com/7738 ]
▶ 참고: 수상포집 [ https://ywpop.tistory.com/3490 ]
---------------------------------------------------
두 기체 A와 B가 부피 V인 용기에 함께 있을 경우,
각 기체의 부분 압력을 나타내면,

> P_A = n_A RT / V
> P_B = n_B RT / V
전체 압력, P_T는 돌턴의 분압 법칙에 따라,
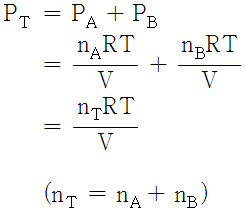
> P_T = P_A + P_B = n_T RT / V
( n_T = n_A + n_B )
전체 압력과 각 기체의 부분 압력 사이의 관계를 알아보면,

여기서 X_A는 기체 A의 몰 분율(mole fraction)이라 한다.
( 몰 분율은 단위가 없는 무차원 양 )
( 참고: 몰분율 https://ywpop.tistory.com/2659 )

> X_a = n_a / (n_a + n_b) = n_a / n_tot
> P_a = X_a × P_tot
> X_A = P_A / P_tot
( A 성분의 몰분율 = A 성분의 분압 / 전체 압력 )
[ 관련 예제 https://ywpop.tistory.com/3435 ] 52.5 g의 산소 기체와 65.1 g의 이산화탄소 기체가 어떤 탱크에 채워져 있다. 탱크 내부의 온도가 27℃, 압력이 9.21 atm일 때, 각 기체의 분압을 구하시오.
[키워드] 돌턴의 분압법칙 기준, 돌턴의 분압법칙 사전, 돌턴 사전, 분압 사전
'일반화학 > [10장] 기체' 카테고리의 다른 글
| 기체의 온도-부피 관계, 샤를의 법칙(Charles's law) ★ (0) | 2012.10.19 |
|---|---|
| 기체의 압력-부피 관계, 보일의 법칙(Boyle's law) ★ (0) | 2012.10.19 |
| Henry의 법칙 (Henry’s law). 기체의 용해도와 압력 효과 ★ (0) | 2012.09.10 |
| 확산. diffusion (0) | 2012.06.21 |
| 제곱근 평균 제곱속도. 제곱 평균근 속도 ★ (0) | 2012.06.21 |
| Kinetic theory of gases. 기체 분자 운동론 ★ (0) | 2012.06.21 |
| 이상 기체 방정식과 기체 상수 ★ (4) | 2012.06.21 |
| 기체로 존재하는 물질 (0) | 2012.06.20 |




댓글