질량 백분율 (퍼센트 농도)
---------------------------------------------------
▶ 참고: 용액의 농도 표시법
[ https://ywpop.tistory.com/2655 ]
---------------------------------------------------
▶ 가장 간단한(단순한, 쉬운) 용액의 농도 표시법
▶ 질량 백분율의 정의
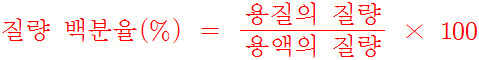

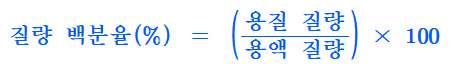
> 질량 백분율(%) = (용질 질량 / 용액 질량) × 100
> 질량 백분율(%) = (용질 g수 / 용액 g수) × 100
> 용액 질량 = 용질 질량 + 용매 질량
▶ 질량비이므로, % w/w 농도임.
( 참고: 퍼센트농도의 종류 https://ywpop.tistory.com/3164 )
▶ %농도는 질량뿐만 아니라 부피, mol수, 개수 등도 적용된다. 예를 들면,
mol% = (용질 mol수 / 용액 mol수) × 100
▶ % w/w 농도 계산 방법
> 용질의 질량과 용액의 질량을 구해서,
“용질의 질량 / 용액의 질량 × 100” 하면 된다.
---------------------------------------------------
%농도 = (용질 질량 / 용액 질량) × 100 이므로,
▶ 용질 질량 = 용액 질량 × (%농도/100)
▶ 용액 질량 = 용질 질량 / (%농도/100)
[ 관련 예제 https://ywpop.tistory.com/8951 ]
[참고] 수득률 = (실제 수득량 / 이론적 수득량) × 100 이므로,
▶ 실제 수득량 = 이론적 수득량 × (수득률/100)
▶ 이론적 수득량 = 실제 수득량 / (수득률/100)
[ 관련 글 https://ywpop.tistory.com/61 ]
---------------------------------------------------
예) 35% HCl 용액 100 g
⇨ 100 g 용액 중에 35 g HCl이 용해되는 있는 용액
⇨ 35 g HCl(용질) + 65 g H2O(용매) = 100 g HCl 용액
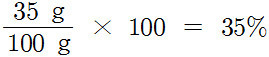
예) 1% NaCl 용액 100 g
⇨ 1 g NaCl(용질) + 99 g H2O(용매) = 100 g NaCl 용액
---------------------------------------------------
예제) 물 100 g에 설탕 13.5 g을 넣어 용해시켰다.
이 용액의 질량 백분율은 얼마인가?
풀이)
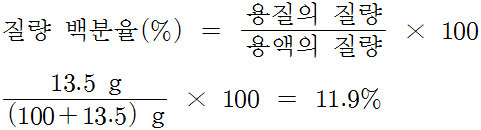
[참고] 어떤 분말에 대하여 20% solution을 만들라고 하면,
20% = [ 20 g 분말 / 100 g solution ] × 100
= [ 20 g 분말 / (20 g 분말 + 80 g 물) ] × 100
분말과 물의 질량 비 = 용질과 용매의 질량 비 = 20 : 80
[ 관련 글 https://ywpop.tistory.com/12958 ] 화학식과 조성 백분율
[ 관련 글 https://ywpop.blogspot.com/2024/01/100.html ]
퍼센트 농도에서 100을 곱하는 이유
[키워드] 질량 백분율 기준, 질량 백분율 농도 기준, 퍼센트 농도 기준, 질량 백분율 사전, 질량 백분율 농도 사전, 퍼센트 농도 사전
'화학 > 용액의 농도' 카테고리의 다른 글
| 물의 몰농도(M)는 55.6 M. Molarity of Water (1) | 2014.12.15 |
|---|---|
| 같은 질량의 글리세롤(C3H8O3)과 물을 포함하는 용액의 농도 (0) | 2014.10.09 |
| 98% 황산 용액의 몰농도 (d 1.84) ★ (4) | 2014.10.04 |
| 몰농도(molarity, M), 몰랄농도(molality, m) ★ (8) | 2014.07.07 |
| 몰분율 (mole fraction) ★ (3) | 2014.07.04 |
| 백만분율(ppm), 십억분율(ppb) ★ (6) | 2014.07.03 |
| 몰농도(M) 몰랄농도(m) 환산(변환) ★ (0) | 2012.09.11 |
| 몰농도 사용할 때 문제점 (2) | 2012.06.21 |



댓글