결합 엔탈피와 반응 엔탈피
bond enthalpy and enthalpy of reaction
---------------------------------------------------
▶ 참고: 제8장 화학 결합의 기본 개념. 목차
[ https://ywpop.tistory.com/15249 ]
---------------------------------------------------

결합 엔탈피 값을 이용하여 반응 엔탈피를 구할 수 있다.
다음 반응에서와 같이

C–H, Cl–Cl 결합이 끊어지고, C–Cl, H–Cl 결합이 생성된다면,
( 모두 1 mol씩 끊어지고, 생성된다. )

반응 엔탈피는 다음 식으로 구할 수 있다.
ΔH_rxn = Σ[절단 결합의 ΔH_B] – Σ[생성 결합의 ΔH_B]

[참고] CH4 분자에서 실제 C–H 결합 엔탈피 값과
CH3Cl 분자에서 실제 C–H 결합 엔탈피 값은 서로 다르다.
계산에 사용된 C–H 결합 엔탈피 값은
수많은 분자에 존재하는 C–H 결합 엔탈피 값들을 평균한 값이다.
그래서 이름도 ‘평균’ 결합 엔탈피라고 부르는 것이다.
이 때문에 위 공식으로 계산한 반응 엔탈피 값, 즉
평균 결합 엔탈피 값으로 계산한 반응 엔탈피 값과
표준 생성 엔탈피 값으로 계산한 반응 엔탈피 값은 약간 차이가 발생한다.
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
ΔH°_rxn = [생성물들의 ΔH°_f 합] – [반응물들의 ΔH°_f 합]
( 참고 https://ywpop.tistory.com/3431 )
= [(–83.68 + (–92.30)] – [(–74.85) + (0)]
= –101.13 kJ
예제) 결합 엔탈피 값을 이용하여 물 생성 반응의 반응 엔탈피 구하기.

풀이) H–H 2 mol, O=O 1 mol 끊어지고, O–H 4 mol(4개) 생성되었으므로,
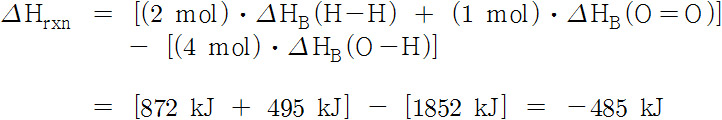

와 비교하면, 약간의 차이가 나는데,
이것은 계산에 사용된 결합 엔탈피 값이 평균 결합 엔탈피 값이기 때문이다.
---> 결합 엔탈피로 계산한 반응 엔탈피는 대략적인 값
( 참고: 결합 엔탈피 https://ywpop.tistory.com/2558 )
[ 관련 예제 https://ywpop.tistory.com/9273 ] 결합 엔탈피와 반응 엔탈피. C2H4(g) + H2(g) → C2H6(g)
생성 엔탈피는 “결합 생성”, 결합 에너지는 “결합 파괴”로,
서로 반대 과정이므로,
한 방법이 “생성물의 값 – 반응물의 값”으로 계산하면,
다른 방법은 “반응물의 값 – 생성물의 값”으로 계산해야지,
둘 다 동일한 부호를 갖는 ΔH의 결과가 나온다.
[키워드] 결합 엔탈피와 반응 엔탈피 기준, 반응 엔탈피와 결합 엔탈피 기준, 결합 에너지와 반응 엔탈피, 결합 에너지와 반응열, 평균 결합 에너지 기준, 평균 결합 엔탈피 기준, 결합 엔탈피로 반응 엔탈피 기준, 08장 화학 결합의 기본 개념-2
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 쌍극자(dipole), 쌍극자모멘트(dipole moment), 분자의 극성 ★ (1) | 2014.06.03 |
|---|---|
| 전기음성도 (electronegativity) ★ (0) | 2014.05.26 |
| 공유 결합의 종류, 분류 (0) | 2014.05.25 |
| 공유 결합. 결합 전자와 비결합 전자 ★ (0) | 2014.05.23 |
| 결합 엔탈피 (bond enthalpy) ★ (0) | 2014.05.21 |
| CO3^2- 루이스 구조 그리기. 탄산 이온 (3) | 2014.05.16 |
| 공유 결합성 화합물에서, 형식 전하와 산화수 ★ (0) | 2014.05.16 |
| 루이스 구조(Lewis structure) 그리기. PCl3 (8) | 2014.05.13 |



댓글