CH3^+ 이온의 혼성 오비탈
탄소 양이온, carbocation, methyl cation의 혼성 오비탈
---------------------------------------------------
▶ 참고: 혼성 오비탈
[ https://ywpop.tistory.com/2639 ]
---------------------------------------------------
이런 문제는
① 중심원자가 몇 개의 결합을 하고 있는가?
② 중심원자의 비공유 전자쌍은 몇 개인가?
즉, 중심원자의 전자 영역은 몇 개인가?
를 생각해 보면 간단하다.
( 참고: 전자 영역 https://ywpop.tistory.com/2569 )
탄소 양이온, CH3^+ 이온에서,
탄소는 수소와 3개의 단일 결합을 하고 있고,
또한 탄소에는 비공유 전자쌍이 없으므로,
탄소의 전자 영역 = 3개.
따라서
탄소 양이온의 혼성 오비탈은
sp2 혼성 오비탈이다.
( 참고 https://ywpop.tistory.com/11542 )
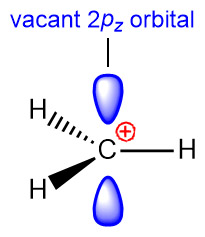
[그림] The structure of methyl cation is trigonal planar,
with an sp2 hybridized carbon and a vacant p orbital.
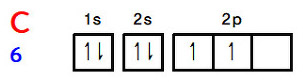
[그림] 탄소 원자의 바닥 상태 전자 배치.
① 탄소 원자의 원자가 전자는 4개.
---> 양이온이 되면, 2p 전자 1개를 잃음.
② 2s 전자 1개가 2p 오비탈로 들뜬 후,
2s 오비탈 1개, 2p 오비탈 2개가 혼성화.
---> 3개의 sp2 혼성 오비탈 + 1개의 빈 2p_z 비혼성 오비탈
[참고] 탄소 음이온, CH3^- 이온은 sp3 혼성 오비탈.
탄소 음이온, CH3^- 이온에서,
탄소는 수소와 3개의 단일 결합을 하고 있고,
또한 탄소에는 비공유 전자쌍이 1개 존재하므로,
탄소의 전자 영역 = 4개.
따라서
탄소 음이온의 혼성 오비탈은
sp3 혼성 오비탈이다.

[그림] The simplest organic carbanion is CH3^-,
which has a trigonal pyramidal structure
with an sp3 hybridized carbon that has a lone pair of electrons.
① 탄소 원자의 원자가 전자는 4개.
---> 음이온이 되면, 2p 오비탈에 전자 1개가 채워짐.
② 2s 오비탈 1개, 2p 오비탈 3개가 혼성화.
---> 4개의 sp3 혼성 오비탈
---> 4개 중 1개는 전자가 짝을 짓고 있다.
------> 1개의 비공유 전자쌍
( 참고: 질소의 sp3 혼성 오비탈 https://ywpop.tistory.com/9952 )
[키워드] 탄소 양이온의 혼성 오비탈 기준문서, 탄소 음이온의 혼성 오비탈 기준문서, CH3^+의 혼성 오비탈 기준문서, CH3^-의 혼성 오비탈 기준문서
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| CCl4 루이스 구조 그리기 (1) | 2023.05.15 |
|---|---|
| 분자 모양. Molecular Shapes (4) | 2023.05.12 |
| CH3CN 루이스 구조 (1) | 2023.04.27 |
| H2SO4 루이스 구조 그리기 (1) | 2023.04.25 |
| CH3O^- 루이스 구조와 형식 전하 (0) | 2023.03.19 |
| 인산의 혼성 오비탈. 인의 혼성 오비탈 (1) | 2023.03.09 |
| 물 분자의 기하구조 (0) | 2023.03.06 |
| 전자쌍 반발 원리로 예측한 분자나 이온의 모양 (0) | 2023.02.16 |




댓글