0.01 M NH3 용액의 pH. Kb=1.75e-5
Calculate the pH and pOH for 0.01 M ammonia (NH3).
NH3의 Kb = 1.75×10^(-5)
[참고] 0.1 M NH3 용액의 pH
[ https://ywpop.tistory.com/6332 ]
Kb = [NH4^+][OH^-] / [NH3] = (x)(x) / (C–x)
( 참고 https://ywpop.tistory.com/4294 )
C–x ≒ C 라 근사처리하면,
x = [Kb × C]^(1/2)
= [(1.75×10^(-5)) × 0.01]^(1/2)
= 0.0004183 M = [OH^-]
0.01 M × (5/100) = 0.0005 M > 0.0004183 M
---> 5% 검증 통과.
( 참고 https://ywpop.tistory.com/5867 )
pOH = –log[OH^-]
( 참고 https://ywpop.tistory.com/2706 )
= –log(0.0004183)
= 3.38
pH = 14.00 – 3.38
= 10.62
[참고] Kb = 2×10^(-5) 값으로 계산하면,
x = [(2×10^(-5)) × 0.01]^(1/2)
= 0.0004472 M = [OH^-]
pOH = –log(0.0004472) = 3.35
[ 관련 예제 https://ywpop.tistory.com/16712 ] 0.001 M NH3 용액의 pH
[ 관련 글 https://ywpop.tistory.com/23831 ] 약염기 용액의 pH 계산 공식
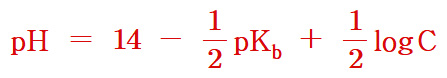
[키워드] NH3 용액의 pH 기준, NH3 용액의 pH 사전
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| pH 4.5인 NH4Cl 용액의 몰농도 (0) | 2021.05.28 |
|---|---|
| [OH^-] = 8.2×10^(-10) M 용액의 pH (1) | 2021.05.26 |
| 0.25 M NH4Cl 용액의 pH. Kb=1.75e-5 (1) | 2021.05.20 |
| 0.1 M CH3COONa 용액의 pH. Ka=1.75e-5 (0) | 2021.05.20 |
| 1.0 M H2A 용액의 pH (0) | 2021.05.19 |
| 0.1 M HCl 23 mL + 0.1 M NH3 ? mL (0) | 2021.05.19 |
| [OH^-] = 2.1×10^(-10) M 용액에서 수소이온의 몰농도 (1) | 2021.05.17 |
| pH가 11.7인 0.1 M NH3 용액의 Kb (1) | 2021.05.15 |
댓글