redox balance. H2 + O2 → H2O
산화-환원 반응 완성하기. H2 + O2 → H2O
---------------------------------------------------
▶ 참고: 산화-환원 반응 균형 맞추기 (산성 용액)
[ https://ywpop.tistory.com/4264 ]
---------------------------------------------------
1. 반쪽 반응식 나누기
산화: H2 → H2O (H의 산화수는 0에서 +1로 증가, H2는 산화됨.)
환원: O2 → H2O (O2의 산화수는 0에서 –2로 감소, O2는 환원됨.)
> H2 is a reducing agent.
> O2 is an oxidizing agent.
2. 질량 균형 맞추기
산화: H2 + H2O → H2O + 2H^+
환원: O2 + 4H^+ → 2H2O
3. 전하 균형 맞추기
산화: H2 + H2O → H2O + 2H^+ + 2e^-
환원: O2 + 4H^+ + 4e^- → 2H2O
4. 주고받은(이동한) 전자 수 같도록
산화: 2H2 + 2H2O → 2H2O + 4H^+ + 4e^-
환원: O2 + 4H^+ + 4e^- → 2H2O
5. 반쪽 반응식 더하기. 끝.
2H2 + O2 → 2H2O
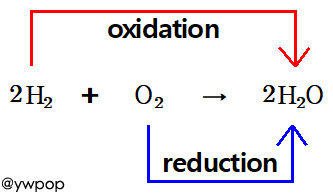
[ 관련 글 https://ywpop.tistory.com/16287 ] redox H2 + O2 → H2O. 산화수 설명
[ 관련 글 https://ywpop.tistory.com/5654 ] redox balance. H2O → H2 + O2 (물의 전기분해)
[ 관련 글 https://ywpop.tistory.com/20940 ] redox balance. C3H8 + O2 → CO2 + H2O
[키워드] redox H2 + O2 → H2O dic, redox O2 + H2 dic, redox H2O dic, redox 2H2 + O2 → 2H2O dic
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| redox balance. I3^- + S2O3^2- → I^- + S4O6^2- (acidic/basic) (0) | 2020.12.27 |
|---|---|
| redox balance. IO3^- + I^- → I2 (acidic) (0) | 2020.12.11 |
| 리튬 이온 배터리 산화-환원 반응 ★ (0) | 2020.12.08 |
| redox balance. K2Cr2O7 + H2O + S → KOH + Cr2O3 + SO2 (basic) (0) | 2020.11.26 |
| redox NaBr + Cl2 → NaCl + Br2 (1) | 2020.10.13 |
| 산화-환원 적정. 0.0500 M Fe^2+ 100.0 mL + 0.100 M Ce^4+ (1) | 2020.10.02 |
| redox balance. HPO3^2- + MnO4^- → PO4^3- + MnO4^2- (basic) (0) | 2020.09.29 |
| redox balance. NH3 + O2 → NO + H2O (0) | 2020.07.07 |


댓글