MO of NO. NO의 분자오비탈
NO molecular orbital diagram
[참고] 분자 오비탈 이론. MOT
[ https://ywpop.tistory.com/6048 ]

[그림] NO의 분자오비탈. 홀전자 1개가 존재하므로, NO는 상자기성 물질.
[주목1] 전기음성도가 더 큰 산소 원자(O)의 AO의 에너지 준위가
질소 원자(N)의 AO의 에너지 준위보다 조금 더 낮다.
( 이유는 대학교 일반화학 수준에서 설명 불가능. 대학교 1학년까지는 그냥 외울 것. )
( 양자역학(의 수식)으로 설명 가능. 즉, 양자역학을 마스터한 다음에 이유를 따질 것. )
[주목2] NO의 루이스 구조에서 홀전자는 N에 위치하고 있는데,
( 참고: NO의 루이스 구조 https://ywpop.tistory.com/2832 )
NO의 MO에서 그것을 확인할 수 있다. 즉, NO의 MO가 그것을 증명해준다.
---> π*에 있는 홀전자의 에너지 준위는 질소 원자(N)의 AO와 더 가깝다.
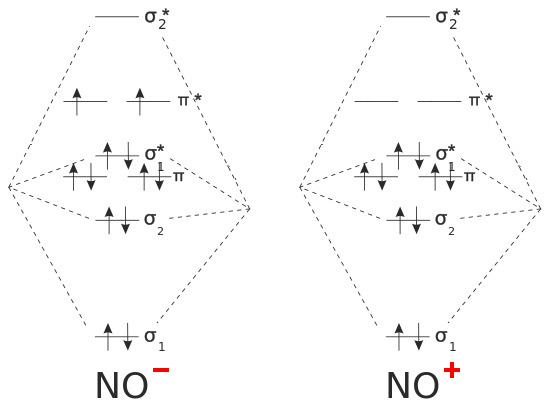
[그림] NO^-의 분자오비탈과 NO^+의 분자오비탈.
▶ NO^-의 자기적 성질: 홀전자 2개가 존재하므로, NO^-는 상자기성 물질.
▶ NO^+의 자기적 성질: 홀전자가 존재하지 않으므로, NO^+는 반자기성 물질.
[ 관련 글 https://ywpop.tistory.com/11979 ] 다른 모양의 NO의 MO
[ 관련 글 https://ywpop.tistory.com/3224 ] 분자의 자기적 성질
---------------------------------------------------
NO 분자와 이온의 결합 차수
▶ 결합 차수 = 1/2 (결합성 MO 전자 수 – 반결합성 MO 전자 수)
( 참고 https://ywpop.tistory.com/6879 )
> NO^2-의 결합 차수 = (8 – 5) / 2 = 3/2
> NO^-의 결합 차수 = (8 – 4) / 2 = 2
> NO의 결합 차수 = (8 – 3) / 2 = 5/2
> NO^+의 결합 차수 = (8 – 2) / 2 = 3
> NO^2+의 결합 차수 = (8 – 1) / 2 = 7/2
[키워드] nitric oxide의 MO 기준, 일산화질소의 MO 기준, nitric oxide의 분자오비탈 기준, 일산화질소의 분자오비탈 기준, 일산화질소의 결합차수 기준, NO의 결합차수 기준, 일산화질소 결합차수 기준, 일산화질소 결합차수 사전, 일산화질소 분자오비탈 기준, 일산화질소 분자오비탈 사전, MO of NO 기준, MO of NO dic
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 프로필렌(CH3-CH=CH2)에 존재하는 화학 결합 방식 (0) | 2020.02.11 |
|---|---|
| XeF2의 루이스 구조 (2) | 2020.02.01 |
| 분자 오비탈 이론. σ MO와 π MO (1) | 2019.12.31 |
| Li2 분자의 MO 도표. MO diagram of Li2 (2) | 2019.12.30 |
| I3^- 루이스 구조 그리기. I3^- Lewis structure (0) | 2019.06.17 |
| 중심원자의 혼성오비탈 결정 ★ (1) | 2019.06.15 |
| SCl2 루이스 구조 그리기 (0) | 2019.06.15 |
| 분자의 모양. 삼각 평면, 사면체, 팔면체 (0) | 2019.06.03 |




댓글