redox balance. KMnO4 + H2O2 + H2SO4 → MnSO4 + O2 + K2SO4 + H2O (acidic)
산화-환원 반응 완성하기. KMnO4 + H2O2 + H2SO4 → MnSO4 + O2 + K2SO4 + H2O
과망간산칼륨과 과산화수소의 산화-환원 반응
---------------------------------------------------
▶ 참고: 산화-환원 반응 균형 맞추기 (산성 용액)
[ https://ywpop.tistory.com/4264 ]
---------------------------------------------------
산화-환원 반응의 특징을 잘 이해하고 있다면,
반응식을 간단히 만들 수 있다.
그러면, 산화-환원 반응의 본질을 이해하기도 쉽고,
균형 맞추기도 쉽다.
주어진 반응식에서,
1) H2SO4는 촉매이므로, 제거한다.
( 같은 이유로, H^+ 또는 OH^-가 있다면 제거한다. )
2) 용매인 H2O는 질량 균형을 맞추기 위해 사용된 것이므로, 제거한다.
( H2O는 용매이므로, 제거한다. )
3) K^+와 같은 양이온은 구경꾼 이온이므로, 제거한다.
그러면, 다음과 같이 반응식이 간단해진다.
MnO4^- + H2O2 → Mn^2+ + O2
> MnO4^-에서 Mn의 산화수 = +7
> Mn^2+에서 Mn의 산화수 = +2
---> Mn의 산화수 감소, MnO4^-는 환원됨.
( MnO4^-는, 즉 KMnO4는 산화제 )
> H2O2에서 O의 산화수 = –1
> O2에서 O의 산화수 = 0
---> O의 산화수 증가, H2O2는 산화됨.
( H2O2는 환원제 )
---------------------------------------------------
1. 반쪽 반응식 나누기
산화: H2O2 → O2
환원: MnO4^- → Mn^2+
2. 질량 균형 맞추기
산화: H2O2 → O2 + 2H^+
환원: MnO4^- + 8H^+ → Mn^2+ + 4H2O
3. 전하 균형 맞추기
산화: H2O2 → O2 + 2H^+ + 2e^-
환원: MnO4^- + 8H^+ + 5e^- → Mn^2+ + 4H2O
[참고] 위 반응식으로부터,
> H2O2의 당량수 = 2 eq/mol
> KMnO4의 당량수 = 5 eq/mol
( 참고: 당량 https://ywpop.tistory.com/5411 )
4. 주고받은(이동한) 전자 수 같도록
산화: H2O2 → O2 + 2H^+ + 2e^- (×5)
환원: MnO4^- + 8H^+ + 5e^- → Mn^2+ + 4H2O (×2)
산화: 5H2O2 → 5O2 + 10H^+ + 10e^-
환원: 2MnO4^- + 16H^+ + 10e^- → 2Mn^2+ + 8H2O
산화: 5H2O2 → 5O2
> 산화된 O의 산화수 변화: 5 × 2 × (–1) → 5 × 2 × (0)
---> –10 → 0
---> 10 증가
환원: 2MnO4^- → 2Mn^2+
> 환원된 Mn의 산화수 변화: 2 × (+7) → 2 × (+2)
---> +14 → +4
---> 10 감소
5. 반쪽 반응식 더하기
2MnO4^- + 5H2O2 + 6H^+ → 2Mn^2+ + 5O2 + 8H2O
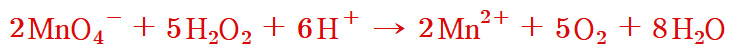
6. 구경꾼 이온, K^+, SO4^2- 추가. 끝.
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + 8H2O + K2SO4
[ 동일 예제 https://ywpop.tistory.com/3342 ]
redox balance. MnO4^- + H2O2 + H^+ → Mn^2+ + O2 + H2O
[ 관련 글 https://ywpop.tistory.com/3795 ] KMnO4의 당량수
[ 관련 글 https://ywpop.tistory.com/9023 ] H2O2의 당량수
[ 관련 글 https://ywpop.tistory.com/8481 ] H2O2는 산화제
redox. 2HI + H2O2 → I2 + 2H2O
[키워드] redox KMnO4 + H2O2, redox H2O2 + KMnO4, H2O2는 환원제 기준, H2O2 산화-환원 반응 기준
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| redox balance. Mn^2+ + IO4^- → MnO4^- + IO3^- (1) | 2018.05.09 |
|---|---|
| redox balance. I2 + IO3^- + H^+ + Cl^- → ICl2^- + H2O (0) | 2018.04.23 |
| redox balance. ClO3^- + Cl^- → Cl2 + ClO2 (acidic) (1) | 2018.04.16 |
| 전기분해의 화학량론. CuSO4 수용액 10 A 30분 (0) | 2018.03.27 |
| redox balance. Fe + MnO4^- → Fe^3+ + Mn^2+ (acidic) (0) | 2018.02.08 |
| redox balance. MnO4^- + SO2 → Mn^2+ + SO4^2- (acidic) (0) | 2018.01.09 |
| 산화-환원 반응에서, 산성 조건? 염기성 조건? (0) | 2017.12.19 |
| 표준 환원 전위로부터 표준 기전력 계산. 전극 전위는 세기 성질 (0) | 2017.12.18 |
댓글