S4O6^2-의 산화수. tetrathionate anion의 산화수
What is the oxidation number of sulfur in S4O6^2-?
---------------------------------------------------
▶ 참고: 산화수 구하는 규칙
[ https://ywpop.tistory.com/2719 ]
---------------------------------------------------
S4O6^2- 에서,
O의 산화수 = –2 (넘버 3) 이므로,
4(S) + 6(O) = –2
4(S) + 6(–2) = –2
4(S) = +10
S = +(10/4) = +(5/2) = +2.5
따라서
S의 산화수 = +2.5 이나,
이것은 4개 S의 산화수의 평균값.
실제 각각의 S의 산화수는
red S의 산화수 = +5
blue S의 산화수 = 0
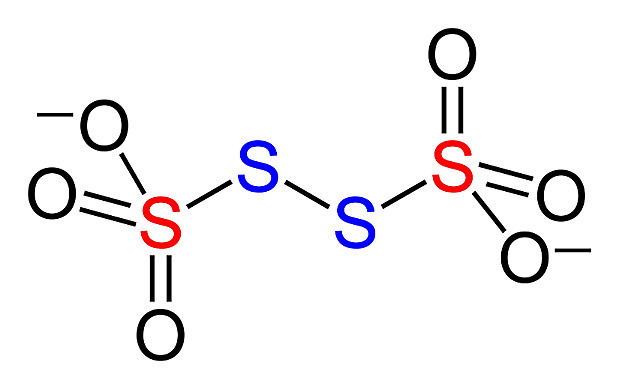
[그림] S4O6^2-의 구조식.
> 4개 S의 산화수의 합계 = +10
( 참고: 유기물의 산화수 계산 https://ywpop.tistory.com/7863 )
[ 관련 글 https://ywpop.tistory.com/11180 ] Na2S4O6의 산화수
[ 관련 글 https://ywpop.tistory.com/5637 ] Fe3O4의 산화수
[키워드] S4O6^2-의 산화수 기준문서, 산화수가 분수인 경우 기준문서, 산화수가 분수 기준문서, 분수인 산화수 기준문서, 정수가 아닌 산화수 기준문서
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 알짜이온반응식. Zn + H2SO4 → ZnSO4 + H2 (0) | 2018.04.23 |
|---|---|
| 산화제와 환원제. redox CH4 + H2O → CO + 3H2 (2) | 2018.04.03 |
| 물 1 L에 NaOH를 0.4 g 녹인 용액의 pH ★ (0) | 2018.03.31 |
| IO3^-의 산화수. I3^-의 산화수 (0) | 2018.03.14 |
| PbSO4의 산화수 (0) | 2018.02.18 |
| SO4^2-의 산화수. 황산이온의 산화수. 황의 산화수 (0) | 2018.02.18 |
| H2O2의 산화수 (0) | 2018.01.24 |
| redox. 2HI + H2O2 → I2 + 2H2O (0) | 2018.01.24 |


댓글