표준 수소 전극
Standard Hydrogen Electrode, SHE (그녀)
---------------------------------------------------
▶ 참고: 제20장 전기화학. 목차
[ https://ywpop.tistory.com/11389 ]
---------------------------------------------------

▶ 표준 수소 전극에서 백금(Pt) 금속의 기능
① 불균일 촉매
② 전도체(전선): 외부 회로와 연결

▶ 표준 수소 전극은 상대 전극에 따라, 환원전극 또는 산화전극 역할.
> 환원전극(SHE as cathode) 반응: 2H^+(aq) + 2e^- → H2(g)
> 산화전극(SHE as anode) 반응: H2(g) → 2H^+(aq) + 2e^-
( 참고: 전기화학에서 표준상태 https://ywpop.tistory.com/4583 )
[ 전극의 표준 환원 전위 결정(계산) ]
1) 전극 전위를 알고 싶은 전극(반쪽 전지)과
표준 수소 전극으로 전지를 구성한다.
2) 외부 전압계의 기전력을 측정한다.
3) 전지 규약에 따라,
반쪽 전지의 표준 환원 전위를 계산한다.
E°_cell = E°_red(환원전극) – E°_red(산화전극)
= (환원된 물질의 표준환원전위) – (산화된 물질의 표준환원전위)
( 참고 https://ywpop.tistory.com/4558 )
---> 이렇게 실험으로 모든 전극의 표준 환원 전위를 구했다.
( 참고: 표준환원전위 도표 https://ywpop.tistory.com/7027 )


※ 표준 산화 전위란 용어도 있는데,
표준 환원 전위의 부호만 바꾸면 된다.
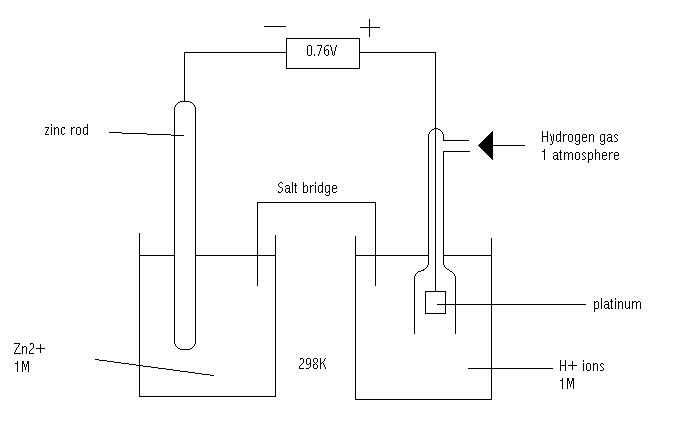
[ 그림 출처 commons.wikimedia.org ] 오른쪽이 표준 수소 전극.
예) 아연 전극의 표준 환원 전위 결정
1) 위 그림과 같이 아연 반쪽전지와 표준수소전극으로 전지를 구성한다.
> 산화: Zn(s) → Zn^2+(aq) + 2e^-
> 환원: 2H^+(aq) + 2e^- → H2(g)
2) 이때 외부 전압계의 기전력 = 0.76 V
3) 약속에 따라, 표준수소전극의 E°_red = 0 V 이므로,
E°_cell = E°_red(환원전극) – E°_red(산화전극)
= (표준수소전극의 E°_red) – (아연전극의 E°_red)
0.76 V = (0 V) – (? V)
? = –0.76 V
---> 아연 전극의 표준 환원 전위
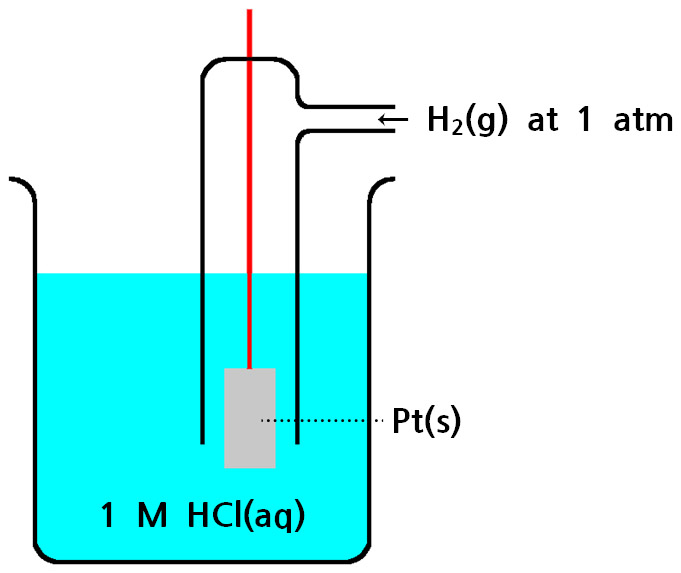
[그림] Standard Hydrogen Electrode.
[참고]
standard hydrogen electrode cell representation
standard hydrogen electrode cell diagram
standard hydrogen electrode cell notation
Pt | H2(g) | 2H^+(aq) ||
또는
Pt [H2(g)] | 2H^+(aq) ||
▶ SHE가 산화 전극(anode half-cell)일 경우
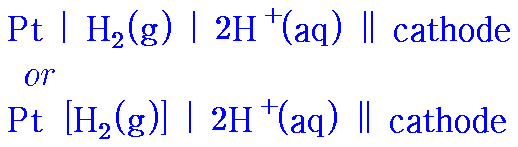
▶ SHE가 환원 전극(cathode half-cell)일 경우
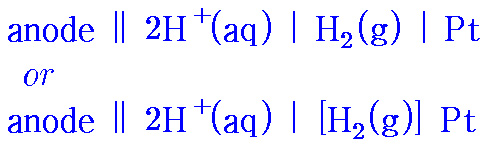
[ 관련 글 https://ywpop.tistory.com/12712 ] 포화 칼로멜 전극 (saturated calomel electrode, SCE)
[ 관련 글 https://ywpop.tistory.com/3072 ] 볼타 전지 간단 표기법, cell diagram
[키워드] 표준 수소 전극 기준문서, she 기준문서, 불균일 촉매 기준문서, 표준 수소 전극 사전, she dic
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| redox balance. Fe + MnO4^- → Fe^3+ + Mn^2+ (acidic) (0) | 2018.02.08 |
|---|---|
| redox balance. MnO4^- + SO2 → Mn^2+ + SO4^2- (acidic) (0) | 2018.01.09 |
| 산화-환원 반응에서, 산성 조건? 염기성 조건? (0) | 2017.12.19 |
| 표준 환원 전위로부터 표준 기전력 계산. 전극 전위는 세기 성질 (0) | 2017.12.18 |
| 전기화학 전지 용어 정의 ★ (3) | 2017.12.14 |
| redox balance. I2 + Cl2 → IO3^- + Cl^- (0) | 2017.12.12 |
| redox balance. Al + CuCl2 → AlCl3 + Cu (0) | 2017.12.02 |
| redox balance. H2O2 + Fe^2+ → Fe^3+ + H2O (acidic) (0) | 2017.11.27 |


댓글