728x170
약산 0.060 M 용액의 pH가 3.44일 때, Ka 계산
어떤 약산인 일양성자산 0.060 M의 pH가 3.44이다.
이 산의 Ka를 계산하시오.
어떤 약산인 일양성자산 0.060 M 용액의 pH가 3.44이다.
이 산의 Ka를 구하시오.
---------------------------------------------------
pH = –log[H^+] = 3.44
[H^+] = 10^(-3.44) = 0.000363 M
---> 평형에서의 [H^+]
............. HA(aq) ⇌ H^+(aq) + A^-(aq)
평형(M) . C–x ......... x ............. x
산 이온화상수 식, Ka = (x) (x) / (C–x) 에서,
C = 0.060 M, x = 0.000363 M 이므로,
Ka = (0.000363)^2 / (0.060–0.000363)
= 2.21×10^(-6)
답: Ka = 2.2×10^(-6)
[ 관련 예제 https://ywpop.tistory.com/2981 ] 0.5 M HF 용액의 pH
반응형
그리드형(광고전용)
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 10^–7 M HCl, 10^–8 M HCl과 같은 묽은 염산의 pH ★ (7) | 2015.11.09 |
|---|---|
| 탄산나트륨(sodium carbonate, Na2CO3)의 노르말농도(normality) (0) | 2015.10.22 |
| 약산의 산 이온화상수(산 해리상수), Ka와 pKa (0) | 2015.10.21 |
| 탄산칼슘은 염기성 염. CaCO3 basic salt ★ (2) | 2015.10.19 |
| 약산(CH3COOH) <- 강염기(NaOH) 중화 적정. 적정 중 용액의 pH (0) | 2015.10.17 |
| 0.01 M HCl 용액과 0.10 M KOH 용액의 pH (0) | 2015.10.14 |
| 0.01 M 암모니아 수용액의 이온화도는 4.3% (0) | 2015.10.05 |
| 3가지 인의 산소산의 세기. H3PO2, H3PO3, H3PO4 (2) | 2015.08.28 |
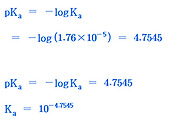

댓글